Por Yan Luca Alencar Ferreira
Estudo retrospectivo e comparativo da funcionalidade e morfologia cardíaca em cães submetidos ao tratamento quimioterápico com cloridrato de doxorrubicina
RESUMO
A cardiotoxicidade é um dos efeitos adversos mais significativos do tratamento oncológico, responsável por uma considerável morbimortalidade. Entre as ações lesivas dos fármacos quimioterápicos no sistema cardiovascular, destaca-se, pela sua maior frequência e gravidade, a ocorrência de insuficiência cardíaca com disfunção ventricular sistólica. Outros efeitos tóxicos cardiovasculares incluem hipertensão arterial, doença tromboembólica, doenças pericárdicas, arritmias e isquemia miocárdica. Durante várias décadas, a cardiomiopatia induzida pela terapêutica oncológica era quase exclusivamente associada ao uso de doses cumulativas de antraciclinas, que promovem lesões permanentes a nível celular. No entanto, o uso de novos agentes terapêuticos, como o anticorpo monoclonal, induz uma disfunção transitória reversível dos miócitos sem que haja relação com a dose utilizada. Atualmente, é essencial para os pacientes oncológicos a identificação precoce da lesão cardiovascular, o diagnóstico preciso de eventos cardiotóxicos e a implementação de planos de monitorização adequados. Neste contexto, é essencial na prática clínica uma cooperação entre cardiologistas e oncologistas, de forma a equilibrar os riscos cardiotóxicos com os benefícios da terapia antineoplásica em pacientes oncológicos. Neste estudo veremos as diversas respostas cardiotóxicas ao uso de tratamentos oncológicos e a sua relação com a administração do cloridrato de doxorrubicina usados na prática clínica. Além disso, serão analisadas as principais linhas de diagnósticos como pesquisa e monitorização da cardiotoxicidade nos indivíduos em tratamento oncológico.
{PAYWALL_INICIO}
Palavras-chave: Doxorrubicina, Cardiopatia, Cardiotoxicidade.
ABSTRACT
Cardiotoxicity is one of the most significant adverse effects of cancer treatment, responsible for considerable morbidity and mortality. Among the damaging events of chemotherapy drugs in the cardiovascular system, due to their greater frequency and severity, the occurrence of heart failure with systolic ventricular dysfunction stands out. Other toxic cardiovascular effects include high blood pressure, thromboembolic disease, pericardial diseases, arrhythmias and myocardial ischemia. For several decades, cardiomyopathy induced by cancer therapy was almost exclusively associated with the use of cumulative doses of anthracyclines, which promote permanent cellular damage. However, the use of new therapeutic agents, such as the monoclonal antibody, induces a reversible transient dysfunction of the myocytes without regard to the dose used. Currently, it is essential for cancer patients the early identification of cardiovascular injury, the accurate diagnosis of cardiotoxic events and the implementation of adequate monitoring plans. In this context, close cooperation between cardiologists and oncologists is essential in clinical practice in order to balance cardiotoxic risks with the benefits of antineoplastic therapy in cancer patients. In this study we will look at the various cardiotoxic responses to the use of cancer treatments and their relationship with the administration of doxorubicin hydrochloride used in clinical practice. In addition, the main lines of diagnosis such as research and monitoring of cardiotoxicity in individuals undergoing cancer treatment will be analyzed.
Keywords: Doxorubicin, Heart disease, Cardiotoxicity.
INTRODUÇÃO
As antraciclinas são antibióticos citostáticos que tem a ação de inibição da topoisomerase II. Os fármacos mais representativos desse grupo são a doxorrubicina, usada contra neoplasias hematológicos e sólidos e a daunorrubicina, utilizada principalmente na formação hematológica aguda. Também fazem parte do grupo das antraciclinas os fármacos epirrubicina, idarrubicina e mitoxantrona.
O cloridrato de doxorrubicina foi isolada de culturas de Streptomyces peucetius, variante caesius, e tem sido utilizada na prática oncológica desde a década de 1960. A identificação de seu alvo, assim como das antibióticos, foi um marco importante na farmacologia das substâncias antitumorais. A regressão tumoral é expressiva no uso isolado da doxorrubicina é significativamente maior quando combinada a outros agentes antitumorais. Apesar disso, sua utilidade clínica é limitada devido a seu potencial cardiotóxico e possibilidade de desenvolvimento de resistência ao fármaco.
Historicamente duas descobertas sobre a doxorrubicina foram importantes para os cardiologistas. Primeiro, que a cardiotoxicidade relaciona-se à dose cumulativa e, segundo, que mudanças estruturais características em miócitos ocorrem e podem ser quantificadas por microscopia eletrônica. A cardiomiopatia induzida pelo quimioterápico dependente da dose foi descrita pela primeira vez em 1971, em tratados com cloridrato de doxorrubicina contra uma variedade de tumores. Mais tarde, em 1984, foram evidenciados os efeitos da cardiotoxicidade com o reconhecimento de alterações ultraestruturais observadas em material de biopsia cardíaca. Até então a importância dos efeitos cardiotóxicos da doxorrubicina não eram reconhecidos. Quase uma década depois, mais uma evidência de morte celular foi observada pelo aumento dos níveis séricos de troponina I cardíaca, e pela demonstração da relação matemática entre doses cumulativas de doxorrubicina em função da probabilidade da ocorrência de insuficiência cardíaca congestiva.
A cardiotoxicidade induzida pela administração desses quimioterápicos é classificada de acordo com o dano celular provocado. A cardiotoxicidade tipo I implica em morte celular por necrose ou apoptose, sendo, portanto, irreversível. Na cardiotoxicidade tipo II ocorre apenas disfunção celular, sendo então considerada reversível. As antraciclinas e os anticorpos monoclonais, como o trastuzumabe, promovem lesões irreversíveis e reversíveis, respectivamente.
Hoje, mesmo com o uso de protocolos com baixas doses e regimes cardioprotetores disponíveis, a cardiotoxicidade pela doxorrubicina ainda ocorre e a prevenção continua a ser o objetivo de cardiologistas e oncologistas. A cardiotoxicidade das antraciclinas são frequentes com doses acima de 180 mg/m2 a 240 mg/m2 e atribuída principalmente à lipoperoxidação das membranas dos cardiomiócitos.
Alguns algoritmos propostos para a triagem de pacientes antes do tratamento e para avaliar a função cardíaca durante e após a terapia não possuem dados que demonstrem vantagem de um programa de monitoramento em desfunção de outro.
Apesar dos esforços investigativos, o mecanismo de cardiotoxicidade induzida pela doxorrubicina continua mal compreendido e, consequentemente, as formas de prevenção e controle são limitadas. Considerando o uso frequente do cloridrato de doxorrubicina como quimioterápico na medicina veterinária, bem como o efeito cardiotóxico desse fármaco, esse estudo tem como objetivo reunir informações acerca da patogenia, dos métodos diagnósticos de rotina para detecção e análise das lesões induzidas pela terapêutica com o cloridrato de doxorrubicina.
REVISÃO DE LITERATURA
A cardiotoxicidade induzida pelo cloridrato de doxorrubicina é classificada cronologicamente em aguda, subaguda, crônica e tardia, de acordo com o tempo entre a administração do fármaco e o início dos sintomas de toxicidade. A forma aguda, ocorre durante ou imediatamente após a administração da droga, principalmente quando aplicada em velocidade rápida, e envolve vasodilatação, hipotensão e arritmias. A subaguda é incomum e se manifesta dias após o término da quimioterapia, seguida de pericardite ou miocardite. A forma crônica, recebe mais atenção e tem sido amplamente estudada, se desenvolve semanas ou meses após o término do tratamento, caracterizando-se por cardiomiopatia dilatada, com desenvolvimento subsequente de disfunção contrátil e insuficiência cardíaca em 5-26% dos pacientes, dependendo do regime de tratamento, da idade, dose, suscetibilidade individual, histórico de hipertensão ou doença cardíaca coronária. A forma tardia se assemelha à crônica, podendo ocorrer anos após o término do tratamento 5, 9, 12.
O que se sabe sobre a cardiotoxicidade induzida pelo quimioterápico decorre principalmente de análises retrospectivas de pacientes com neoplasias que têm insuficiência cardíaca sintomática durante ou após a quimioterapia. Isso leva a grandes variações na estimativa de incidência e prognóstico dessa cardiotoxicidade e tem contribuído para a falta de diretrizes reconhecidas para a vigilância e gestão dessa importante complicação da terapia contra o câncer 1, 15, 19.
Na cardiomiopatia induzida pela doxorrubicina ocorre disfunção contrátil do músculo cardíaco, gerando incapacidade do coração em ejetar sangue e, consequentemente, oxigênio na quantidade ideal para atender as necessidades do metabolismo celular10.
O cloridrato de doxorrubicina possui uma grande afinidade pelo núcleo das células, onde se localizam cerca de 60% do quimioterápico intracelular. Para alcançar o objetivo como quimioterápico, as antraciclinas se intercalam com o DNA, causando ruptura dos filamentos único e duplo, bem como troca de cromátides irmãs, impedindo a multiplicação celular. Similar a outros fármacos que intercalam o DNA, a doxorrubicina possui ação inibidora sobre a topoisomerase II, uma enzima importante no processo de replicação do DNA. Em função desses mecanismos, as antraciclinas podem ser mutagênicas e carcinogênicas2, 7, 16.
Graças a seu grupo quinona, as antraciclinas também liberam radicais livres em tecidos normais e malignos. Para isso, reagem com a citocromo P450 redutase na presença de NADPH, formando intermediários de radicais semiquinonas. Estes, por sua vez, reagem com o oxigênio catabolizado pelo ferro, produzindo radicais de ânion superóxido, que gera peróxido de hidrogênio e radicais hidroxila11, 14, 20.
Há várias hipóteses para explicar a cardiotoxicidade pelas antraciclinas, sendo a formação de radicais livres a mais aceita. Segundo 3, têm sido sugeridas propostas para explicar o motivo pelo qual o coração é o principal alvo de toxicidade desses quimioterápicos. Um composto denominado cardiolipina, presente no interior das mitocôndrias, exerce poder atrativo às antraciclinas10. Essa teoria sugere que a grande quantidade de mitocôndrias nesse tecido pode aumentar significativamente a produção de metabólitos derivados do oxigênio, que em conjunto são chamadas espécies reativas de oxigênio. Uma nova hipótese segue com os níveis das enzimas catalase e glutation peroxidase são menores no tecido cardíaco, reduzindo a atividade antioxidante endógena17, 20.
Há outros mecanismos envolvidos no processo e são possivelmente associados ao estresse oxidativo6. Sabe-se que a doxorrubicina desencadeia a liberação de mediadores químicos inflamatórios, metabólitos do ácido araquidônico e citocinas pró-inflamatórias, que podem favorecer a progressão das lesões nos miócitos 20. Além desses mecanismos, o influxo de cálcio, o distúrbio da função adrenérgica do miocárdio e a interação com o sistema contrátil actina-miosina também foram citados. Tais alterações geram danos intracelulares ou morte dos cardiomiócitos, resultando em futura fibrose miocárdica11.
Atualmente outro mecanismo é considerado importante na cardiotoxicidade pela doxorrubicina, como é o caso de apoptose, que resulta em ativação de proteases e ocorre por diferentes rotas. As mais comuns compreendem a ativação de caspases por via direta, via alteração mitocondrial e por interferência de proteínas citoplasmáticas reguladoras de apoptose17.
Estudos recentes têm sugerido um novo mecanismo da cardiotoxicidade pela doxorrubicina, a ativação do sistema ubiquitina-proteassoma, induzida pela dose terapêutica, gerando proteólise e degradação de fatores de transcrição cardíacos e de proteínas reguladoras de cardiomiócitos. O ubiquitina-proteassoma promove a degradação específica da maioria das proteínas celulares, além de cumprir funções não proteolíticas importantes na célula. Notavelmente, estudos experimentais recentes sugerem que a ativação do proteassoma promove remodelamento cardíaco durante a hipertensão. Além disso, a inibição do proteosoma tem sido clinicamente utilizada para tratar certos tipos de neoplasias e a disfunção do proteassoma é cada vez mais associada à disfunção cardíaca13, 18.
A comprovação de que o cloridrato de doxorrubicina pode vincular-se ao proteassoma na célula antes da translocação para o núcleo levantou a possibilidade de que a mesma pode alterar a função do proteassoma. Entretanto, o mecanismo pelo qual o quimioterapico ativa o proteassoma ainda não foi esclarecido. Evidências experimentais sugerem que a doxorrubicina ativa o ubiquitina-proteassoma em cardiomiócitos in vivo e in vitro, mas se isso ocorre em pacientes oncológicos tratados com doxorrubicina, necessita ser investigado, assim como a contribuição da ativação do ubiquitina-proteassoma na cardiotoxicidade aguda e crônica induzidas pela terapia com o cloridrato de Doxorrubicina 4, 9, 14.
OBJETIVO
O presente estudo tem como objetivo avaliar a funcionalidade e morfologia cardíaca em cães atendidos no Complexo Veterinário da Universidade Cruzeiro do Sul em São Paulo-SP, antes e após tratamento quimioterápico com cloridrato de doxorrubicina, sob orientação principalmente do comparativo dos exames eletrocardiograma e ecodopplercardiograma.
MATERIAL E MÉTODOS
Foi realizado um levantamento do número de casos de pacientes caninos atendidos no Complexo Veterinário da Universidade Cruzeiro do Sul em São PauloSP, submetidos ao tratamento oncológico com cloridrato de doxorrubicina, realizados no período de janeiro de 2017 a dezembro de 2020. A casuística foi obtida de dados arquivados no programa de registro informatizado de relatórios do Complexo Veterinário da Universidade Cruzeiro do Sul. As informações serão agrupadas em banco de dados, com o número de registro dos animais, por data, informações dos animais (espécie, sexo, raça, idade e protocolo quimioterapico) e diagnósticos morfológicos de imagem.
PROTOCÓLO QUIMIOTERAPICO
Houve a seleção dos prontuários de pacientes submetidos ao tratamento com o cloridrato de doxorrubicina, abordando o tipo de neoplasia, a dosagem utilizada, quantidade de sessões realizadas e o tempo geral de tratamento destes pacientes.
AVALIAÇÃO DOS EXAMES CARDIOLÓGICOS
Foram avaliados exames pré e pós terapêutica com o cloridrato de doxorrubicina, tais como, radiografia torácica para análise da silhueta cardíaca, eletrocardiograma com fins de detectar alguma disfunção na condução elétrica do coração e a avaliação dos exames ecodopplercardiograma, com intuito da avaliação tanto funcional quanto da morfologia cardíaca.
RESULTADOS
Após a coleta e análise dos dados retirados do banco de dados arquivados no programa de registro informatizado de relatórios do Complexo Veterinário da Universidade Cruzeiro do Sul, foram totalizados dentre os anos de 2017 a 2020 um total de 68 pacientes oncológicos submetidos ao tratamento com cloridrato de doxorrubicina.
A relação de pacientes quanto ao tipo de neoplasia e duração de tratamento foram inseridos nas tabelas 1, 2, 3 e 4.
Levando em consideração o total de pacientes atendidos, podemos observar que dentre os canídeos que deram entrada no Complexo Veterinário com algum acometimento neoplásico, não há uma grande diferença em relação ao sexo como vemos no gráfico1.

Houve um levantamento em relação a idade desses pacientes, fazendo um comparativo em forma de porcentagem para verificar qual a faixa etária a qual as doenças neoplásicas mais se destacavam (gráfico 2).

Dentre os prontuários avaliados, foi possível observar que a grande maioria dos pacientes aqui descritos não tiveram nenhuma alteração nos exames cardiológicos pós quimioterapia (Gráfico 3).

ELETROCARDIOGRAMA
Ao comparativo dos exames pré e pós quimioterapia, foi possível observar em quatro dos pacientes algumas alterações importantes. No exame eletrocardiográfico detectou-se aumento na amplitude das ondas P e R sugerindo sobrecarga atrial e ventricular esquerda, respectivamente. Além disso, foi observada onda T com amplitude superior à onda R, provavelmente devido a alterações eletrolíticas secundárias ao quadro de diarreia dias após a administração do fármaco, e devido ao quadro de desidratação. Contudo, apenas em um paciente foi possível observar um tipo de arritmia (Figura 1).
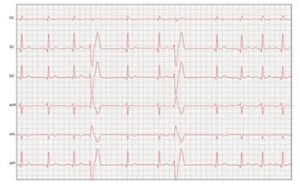
Além do grau de toxicidade, outro fator que pode justificar a ausência de arritmias é o tempo de monitoramento eletrocardiográfico, pois os exames realizados tiveram médias de tempo entre 3 a 5 minutos de avaliação. Como as arritmias são de ocorrência intermitente, avaliações de longo prazo, como as realizadas com Holter, podem detectar alterações não identificadas nos traçados de rotina.
ECODOPPLERCARDIOGRAMA
O efeito cardiotóxico da doxorrubicina pode ser identificado pela ecocardiografia, por meio da qual observou-se diminuição nas medidas de velocidade e deslocamento radiais do ventrículo esquerdo, durante ciclos cardíacos consecutivos em sete dos pacientes citados (Figura 2). Contudo, os demais animais, quando avaliados pelo modo M, apresentaram medidas de fração de ejeção e encurtamento sistólico do ventrículo esquerdo dentro dos valores de referência. Assim, a ecocardiografia se mostrou uma ferramenta diagnóstica de grande valor, uma vez que possibilitou detectar a disfunção ventricular após a finalização das sessões de quimioterapia. Ao contrário do observado na presente pesquisa, há estudos nos quais foram relatadas medidas de fração de ejeção e de encurtamento diminuídas, decorrentes da administração de doxorrubicina (ZHOU et al, 2019). Dessa forma, pode-se inferir que o grau de cardiotoxicidade nos animais estudados não foi elevado, o que explicaria a ausência de alterações no modo M.
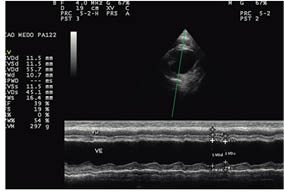
CONCLUSÃO
Conclui-se que o cloridrato de doxorrubicina provoca cardiotoxicidade dose dependente que pode resultar em insuficiência cardíaca e redução progressiva da função ventricular esquerda, a qual pode ser diagnosticada através do exame ecocardiográfico. Entretanto, as doses utilizadas e a duração dos tratamentos foram realizados de forma consensual, e com embasamento científico, o que proporcionou resultados positivos, havendo poucos casos que demonstraram alterações após o fim do protocolo quimioterápico.
REFERÊNCIAS
ALMEIDA, V. L.; LEITÃO, A.; REINA, L. D. C. B.; MONTANARI, C. A.; DONNICI, C. L. Câncer e agentes antineoplásicos ciclo-celular específicos e ciclo-celular não específicos que interagem com o DNA: uma introdução. Química Nova, v. 28, n. 1, p.
118-129, 2005.
BUCHANAN, J.W.; BÜCHELER, J. Vertebral scale system to measure canine heart size in radiographs. Journal of the American Veterinary Medical Association, v. 206, n. 2, p. 194-199, 1995.
CARDOSO, M.; CALUDINO, J.; MELUSSI, M. Mensuração do tamanho cardíaco pelo método VHS (vertebral heart size) em cães sadios da raça American pit bull terrier.
Ciência Rural, v. 41, n. 1, 2011.
CASTRO, M. G.; TÔRRES, R. C. S.; ARAÚJO, R. B.; MUZZI, R. A. L.; SILVA, E. F. Avaliação radiográfica da silhueta cardíaca pelo método vertebral heart size em cães da raça Yorkshire Terrier clinicamente normais. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. v. 63, n. 4, p. 850-857, 2011.
FILHO, K.; I Diretriz Brasileira de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Arquivo Brasileiro Cardiologia, v. 96, n. 2, p. 01-52, 2011.
GORINI, S.; ANGELIS, A. D.; BERRINO, L.; MALARA, N.; ROSANO, G.; FERRARO, E. Chemotherapeutic drugs and mitochondrial dysfunction: focus on Doxorubicin, Trastuzumab, and Sunitinib. Oxidative Medicine and Cellular Longevity, v. 2018, article ID 7582730, 15 pages, 2018.
GRANADOS-PRINCIPAL, S.; QUILES, L. J.; TORTOSA, C. L. R.; ROVIVA, P. S.; RAMIRES-TORTOSA, M. New, advances in molecular mechanisms and the prevention of adriamycin toxicity by antioxidant nutrients. Food and Chemical Toxicology, v. 48, n. 6, p. 1425-1438, 2010.
HALLMAN, B. E.; MARLENE, L. H.; LAUREL, E. W.; PAUL, R. H.; SUSTER, S. E. Incidence and risk factors associated with development of clinical cardiotoxicity in dogs receiving doxorubicin. Journal of Veterinary Internal Medicine. v. 33, n. 2, p. 783- 791, 2019.
JACOBS, G. J. Secondary canine cardiomyopathies: their causes and characteristics. Veterinary Medicine, v. 91, n. 6,p. 534-542, 1996.
JUNGSUWADEE, P. Doxorubicin-induced cardiomyopathy: na update beyond oxidative stress and myocardial cell death. Cardiovascular Regenerative Medicine, v. 3, n. 1127, p. 1-8, 2016.
LEPOUTRE, J. G. Prospective evaluation of Doppler echocardiography, tissue Doppler imaging and biomarkers measurement for the detection of doxorubicininduced cardiotoxicity in dogs: A pilot study. Veterinary Science, v. 105, p. 153-159, 2016.
LOUIS, I.; ASTRA, M. D.; ROBERT, H. P. h. D.; KHALDOUN, T. M. D.;
LARRY, W. S. Doxorubicin-Induced Canine CHF: Advantages and Disadvantages. Division of Cardiothoracic Surgery, Harper Hospital, Wayne State University, Detroit, MI, n. 18, p. 301-306, 2003.
MOHAJERI, M.; SAHEBKAR, A. Protective effects of curcumin against doxorubicininduced toxicity and resistance: a review. Critical Reviews in Oncology/Hematology, v. 122, n. 2, p. 30-51, 2018.
RATTERREE, W.; GIEGER, T.; DVM.; DACVIM.; DACVR.; PARIAUT, R.; DVM.; DACVIM.; SAELINGER, C VMD.; STRICKLAND, K. Value of Echocardiography and Electrocardiography as Screening Tools Prior to Doxorubicin Administration. American Animal Hospital Association, n. 48:2, p. 89-96, 2012.
SILVA, C.; CAMACHO, A. Alterações ecocardiográficas em cães sob tratamento prolongado com doxorrubicina. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 57, n. 3, p. 300-306, 2005.
SURACHETPONG, S. D.; TEEWASUTRAKUL, P.; RUNGSIPIPAT, A. Serial measurements of cardiac troponin I (cTnI) in dogs treated with doxorubicin. Japanese Journal of Veterinary Research, v. 64, n. 4, p. 221-233, 2016.
SUSANECK, S. J. Doxorubicin therapy in dog. Journal of the American Veterinary Medical Association, v. 182, n. 1, p. 70-72, 1983.
MCGOWAN, J. V.; CHUNG, R.; MAULIK, A.; PIOTROWSKA, I.; WALKER, J. M.; YELLON, D. M. Anthracycline Chemotherapy and Cardiotoxicity. Cardiovasc Drugs Ther, n. 31, p. 63–75, 2017.
TATER, G.; EBERLE, N.; HUNGERBUEHLER, S.; JOETZKE, A.; WESS, G.; BETZ, D. Assessment of cardiac troponin I (cTnI) and tissue velocity imaging (TVI) in 14 dogs with malignant lymphoma undergoing chemotherapy treatment with doxorubicin. Veterinary and Comparative Oncology, v. 15, n. 1, p. 55-64, 2017.
XIN, Y.; ZHANG, S.; GU, L.; LIU, S.; GAO, H.; YOU, Z.; ZHOU, G.; WEN, L.; YU, J.;
XUAN, Y. Electrocardiographic and Biochemical Evidence for the Cardioprotective Effect of Antioxidants in Acute Doxorubicin-Induced Cardiotoxicity in the Beagle Dogs. State Key Laboratory of Safety Evaluation for New Drugs, Center of Safety Evaluation, Zhejiang Academy of Medical Sciences; Hangzhou, Zhejiang 310013, China: and b Institutes of Biomedical Engineering, Shanghai University; Shanghai, China, n. 34, p. 1523-1526, 2011.
ZHOU, Z.; XU, L.; WANG, R.; SZEMES, A. V.; DURDEN, A. JSCHOEPF, U. J.; SUN, Z.; FAN, Z. Quantification of doxorubicin-induced interstitialmyocardial fibrosis in a beagle model using equilibrium contrast-enhanced computed tomography: A comparative study with cardiac magnetic resonance T1-mapping. International Journal of Cardiology, n. 281, p. 150-155, 2019.

Yan Luca Alencar Ferreira
Médico Veterinário graduado pela Universidade Cruzeiro do Sul - Campus São Miguel Paulista atuante da área de Clínica Médica de Animais de Pequeno Porte e Arritmologia Veterinária. [email protected]
{PAYWALL_FIM}




