Por Adriana Fragoso Miglioli Visibelli e Fernando Luiz Zanoni
Thromboembolism induced by tick-bornedisase in a dog: case report
Resumo
O tromboembolismo é a obstrução total do fluxo vascular podendo ser gerado principalmente por coágulos. Doenças vasculares, inflamatórias e imunomediadas são suas principais causas, levando ao colapso alveolar; como diagnóstico é necessário realizar exames de sangue, conjuntamente com de imagem sugerindo hipercoagulabilidade e, em alguns casos, é possível diagnosticar em exames tomográficos. As Hemoparasitoses, por gerarem destruição de compostos sanguíneos, geram inflamações importantes e já existem relatos de casos de distúrbios respiratórios relacionados a tais afecções. O relato de caso acompanhou o tratamento e diagnóstico de um cão positivo para Babesiose que apresentou sinais de Tromboembolismo pulmonar.
Palavras chaves: Tromboembolismo, cão, hemoparasitose, babesiose.
{PAYWALL_INICIO}
Abstract
Thromboembolism induced by tick-borne disease in a dog: case report
Thromboembolism is the total obstruction of the vascular flow mainly caused by clots; Vascular, Inflamatory and immunemediated diaseases are the main causes leading to alveolar colapse; the diagnosis is necessary blood test in beetween with images scans, suggesting hypercoagulabity and, in some cases it is possible to diagnose in CT scans. The Tick-borne diseases causes significant inflammation and it has reports of respiratory disorders related to those conditions. This case report has followed the treatment and diagnosis of a dog positive for Babesiosis who has showed signs of pulmonar thromboembolism.
Key words: Thromboembolism, dogs, tick-bone disease, babesiosis.
TROMBOEMBOLISMO
O tromboembolismo é caracterizado pela obstrução total do fluxo vascular, podendo ser gerado por coágulos, embolo séptico ou metastático e até mesmo por gordura. Em animais o tromboembolismo está associado a uma série de desordens fisiológicas que levam a um estado de hipercoagulabilidade, estase sanguínea e dano endotelial (conhecida como Tríade de Virchow)1,2.
Doenças imunomediadas, sepse, neoplasias, coagulação intravascular disseminada (CIVD), doenças vasculares (como a vasculite), hiperadrenocorticismo e grandes cirurgias são as principais causas iniciais das desordens que podem levar ao tromboembolismo1,2,3. Em um estudo post-mortem o tromboembolismo foi observado em 59% dos animais, onde diversos tinham processos patológicos associados e, destes, 55% apresentavam lesões pulmonares2.
Na fisiopatologia do tromboembolismo pulmonar (TEP) há um aumento da resistência vascular pulmonar induzido pela obstrução mecânica do fluxo sanguíneo. O próprio trombo libera mediadores vasoativos que promovem vasocontrição1,2, gerando um aumento do espaço morto alveolar, broncoconstrição, pneumoconstrição e aumento da resistência das vias aéreas3. O efeito shunt se deve à resistência aumentada nas vias aéreas, que resulta na troca gasosa anormal1 devido a incompatibilidade da relação ventilação/perfusão (V/Q), ocorrendo diminuição na produção do surfactante, edema pulmonar e atelectasia. Isso gera hipoxemia, além de uma diminuição da complacência pulmonar, alterando a mecânica respiratória e causando colapso alveolar 2,3,4
Além da taquipneia, é possível observar a distrição respiratória (principalmente expiratória); sons pulmonares aumentados à ausculta, podendo ou não haver crepitações1. Como diagnóstico diferencial, é importante salientar o edema pulmonar – cardiogênico ou não – e, principalmente, a Sindrome do Desconforto Respiratório Agudo (SDRA)2.
Para complementar o diagnóstico é necessário pesquisar a doença de base e, para tal, deve-se realizar exames complementares como hemograma completo e perfil bioquímico2. Em humanos o dímero-D é um importante marcador usado, já que é um produto da degradação de fibrina. Entretanto, ainda é pouco usado na medicina veterinária2.
O dímero-D possui boa sensibilidade quando em concentrações > 500 ng/mL, apesar da especificidade ser de 70% e tendo sua sensibilidade diminuída e especificidade aumentada conforme as concentrações forem aumentando3. Novos estudos mostram que apesar de estar ligado a cascata de coagulação, doenças inflamatórias também podem induzir a um aumento. Em cães com doenças como neoplasia, doença renal, endocrinopatias e doença hepática, e no pós-cirúrgico ocorrem aumento plasmático do dímero-D, excluindo-o como diagnóstico exclusivo para TEP. Além disso, em casos de obstrução arterial crônica os valores de dímero-D podem voltar ao normal5.
Outro exame importante é a tromboelastometria, onde será possível identificar o estado de hipercoagulabilidade do paciente (apesar de não fechar completamente o diagnóstico)2. Além disso, manter uma avaliação regular da função pulmonar através da hemogasometria arterial é fundamental. Apesar de não ser usada como fator prognóstico, poderá ser detectada a hipoxemia (indicando ou não a necessidade de suplementação de oxigênio) ou hipocapnia (devido a hiperventilação). Se calculada a diferença artério-alveolar (a-A) de oxigênio, ela estará aumentada. Na análise do perfil de coagulação, espera-se observar um prolongamento tanto do tempo de protrombina (TP) quanto do tempo de tromboplastina parcialmente ativada (TTPa)1.
A radiografia torácica pode não exibir alterações significativas em 10 a 30% dos animais, estando aparente apenas um aumento das artérias pulmonares1. O ecocardiograma, usado como padrão para avaliação em humanos, poderá mostrar dilatação das artérias pulmonares1 apresentando ou não coágulos, principalmente em região de átrio direito, podendo ter até dilatação ou hipocinesia2. Recentemente, um estudo de Lisciandro e colaboradores relatou a presença de um novo sinal – chamado Wedge – ao se fazer o ultrassom transtorácico usando a técnica Vet BLUE (Bedside Lung Ultrasound Examination)6. Este sinal pode estar relacionado ao tromboembolismo, podendo assim ser mais um exame realizado a beira-leito. Para o diagnóstico definitivo é necessário realizar a tomografia computadorizada de tórax, entretanto, devido à necessidade de anestesiar o paciente este procedimento acaba implicando em alto risco caso ele não esteja compensado2.
O tratamento do TEP deve consistir em restabelecer a oxigenação (revertendo a hipoxemia gerada pela oclusão do vaso pelo trombo) meio de suporte de oxigênio ao paciente.1,2
Pela dificuldade do diagnóstico definitivo, raramente é realizada a trombólise com estreptoquinase ou ativador de plasminogênio2. Pelo alto risco de sangramento difuso um tratamento mais conservador é, na maioria das vezes, o escolhido. Nesse sentido utiliza-se a terapia anticoagulante com heparina sódica (dose de 100 a 300 UI/Kg TID), enoxaparina (1mg/Kg BID ou SID) e clopidogrel1. Também pode-se considerar o uso do ácido acetilsalicílico na dose de 0,5 mg/Kg BID em cães.2
BABESIOSE
A babesiose é uma piroplasmose transmitida pelo carrapato sendo, nessa categoria, a doença mais comum na clínica de pequenos animais. É amplamente distribuída no Brasil, principalmente em áreas urbanas, destacando-se as regiões Sudeste e Nordeste.7
Durante a reprodução do parasita, Babesia sp. rompe as hemácias do hospedeiro, causando anemia regenerativa, hemoglobinúria e bilirrubinemia (com frequente manifestação clínica de icterícia). Além disso há liberação de pirógenos, o que causa hipertermia. Pela hemólise intravascular e ativação intensa do sistema fagocítico mononuclear ocorre hepatomegalia e esplenomegalia. A anemia acarreta hipóxia, reduzindo a oxigenação tecidual e aumentando o metabolismo anaeróbio, com consequente acidose metabólica7.
Em 2013 foi descrito um caso de complicação respiratória associada à babesiose, levando o animal a Síndrome do Desconforto Respiratório Agudo (SDRA)7. Existem também relatos de que SIRS (Systemic Inflammatory Response Syndrome), vasculite e CIVD podem ser complicações de algumas subespécies de Babesias9.
O diagnóstico da babesiose é feito pelas alterações hematológicas e sinais clínicos, sendo confirmados por PCR (Polymerase Chain Reaction). Em casos de infecção aguda pode ser detectável no esfregaço sanguíneo. Sorologias devem ser coletadas a partir do 14º dia pós inoculação, podendo realizar-se de forma pareada com intervalos de 15 dias para confirmação diagnóstica7.
O tratamento consiste na aplicação de dipropionato de imidocarbe (5 a 7 mg/Kg) em duas doses com intervalo de 15 dias. Para evitar os efeitos colaterais, como dor no local de aplicação, lacrimejamento e sialorreia, pode-se aplicar atropina 0,044 mg/Kg previamente (10 min antes da aplicação do imidocarbe). Outro fármaco usado para tratamento é o aceturato de diaminazeno (3,5 mg/kg) porém, devido aos efeitos adversos graves é pouco utilizado na rotina clinica7.
RELATO DE CASO
Um Golden Retriever, de 10 anos, foi admitido no serviço de internação com histórico de hipoxemia não responsiva ao suporte de oxigênio (chegando a receber 5 litros por minuto de Oxigenioterapia) e apresentando hipertermia grave (43ºC), extrassístoles ventriculares e um episódio convulsivo. Foi realizada uma transfusão de concentrado de hemácias, onde houve melhora dos parâmetros hematológicos. Entretanto, posteriormente começou a exibir petéquias, coagulopatia e anasarca, iniciando acompanhamento com hematologista e sendo transferido para setor de terapia intensiva.
As radiografias de tórax evidenciaram opacificação pulmonar de padrão intersticial tendendo a alveolar em hemitórax direito. O perfil de coagulação, inicialmente, não exibia alterações (TP = 9s, TTPa = 21s e fibrinogenio = 180 mg/dL).
Foi então analisado o dímero-D, o qual se mostrou bastante aumentado (3526 ng/mL) e enviado material para realização de urocultura.
No primeiro dia da internação o paciente apresentou boa resposta respiratória à suplementação de oxigênio com baixo fluxo, de 2 L/min. À hemogasometria não se observou hipercapnia e a razão PaO2/FiO2 estava superior a 400, apontando para uma função pulmonar preservada. Ao ultrassom transtorácico não foram evidenciadas linhas B. Foi então instituída terapia anti-inflamatória, anticoagulante e de suporte com dexametasona 0,15 mg/kg/SID, dipirona 30 mg/kg/TID, heparina sódica 150 UI/kg/TID, doxiciclina 10 mg/kg/SID, ondansetrona 1 mg/kg/TID, metadona 0,2 mg/kg/TID, maropitant 1 mg/kg/SID; eritropoetina 200 UI/kg/EDA, gabapentina 6mg/kg/TID e acetilcisteína 10 mg/kg/TID.
No segundo dia de internação uma nova radiografia demonstrou haver melhoria do padrão pulmonar (campos pulmonares dentro dos padrões da normalidade radiográfica). O perfil de coagulação se manteve dentro da normalidade (TP = 8,3s e TTPa = 17,0s). Entretanto, no mesmo período o paciente evoluiu com descompensação hemodinâmica (pressão arterial sistólica – PAS – caiu de 170 mmHg para 100 mmHg) e respiratória, sendo necessário aumento de suplementação de O2 para 3L/min. A razão PaO2/FiO2 diminuiu para 260 (evidenciando um prejuízo na função respiratória) e, pela presença de secreção mucopurulenta em narinas foi associado ao protocolo terapêutico ampicilina + subactam 22 mg/Kg TID.
No dia seguinte o paciente se manteve estável, com saturação (SpO2) variando de 91% a 99% e razão PaO2/FiO2 de 287 em suplementação oxigênio (3L/min). A partir de então iniciou-se o desmame gradativo do oxigênio para 2L/min.
A tromboelastometria em 3 canais demonstrou aumento do CFT e diminuição do ângulo alfa no INTEM (Figura 1), indicando hipercoagulação. Foi então decidido manter a terapia antitrombótica.
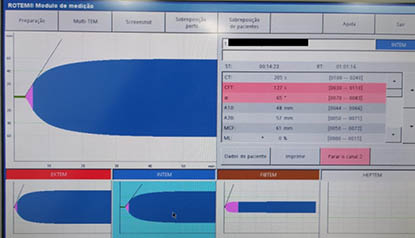
Imagem do ROTEM indicando ao INTEM aumento do ângulo alfa e CFT. Fonte: arquivo pessoal
No 4º dia de internação foi confirmado o diagnóstico para Babesia sp. através do teste de PCR. Foi iniciado o tratamento com imidocarbe (Imizol®) 5 mg/Kg (previamente aplicado atropina 0,022 mg/Kg) e substituição da dexametasona por prednisolona 1 mg/Kg SID. No mesmo período foi reduzida a suplementação de oxigênio para 1 L/min com manutenção dos parâmetros avaliados na hemogasometria.
No dia seguinte houve piora da PaO2 e SaO2, sendo necessário aumentar o fluxo de oxigênio para 1,5 L/min. A heparina foi substituída pela rivaroxabana na dose de 0,5 mg/Kg SID. Novo perfil de coagulação (TP = 5,5 s e TTPa = 11,3s) foi realizado. No mesmo período pode-se reduzir a suplementação de oxigênio para 1L/min, com SpO2 próxima de 94%. O pH (7.41), PCO2 (39 mmHg) e PO2 87 (mmHg) arteriais, bem como Na+ (150 mmol/L), K+ 4 (mmol/L), iCa (1,10 mmol/L), HCO3- (23 mmol/L), BE (-0,4) e SaO2 (95%) estavam dentro da normalidade. Foi tentado a retirada total da suplementação de oxigênio, porém, sem sucesso (PaO2 caiu para 59 mmHg e SpO2 para 90%).
Foi repetida análise do dímero-D (200 ng/mL) e o paciente foi transferido para a internação para dar continuidade ao tratamento, suplementação de oxigênio e monitoração.
Durante mais 4 dias foi necessária a suplementação de oxigênio, com taxas variando de 0,5L a 1L/min. A SpO2 variando de 91% a 94% e piora do padrão ventilatório a depender da saturação. No 5º dia foi possível o desmame completo da suplementação de oxigênio, com SpO2 se mantendo em 94% e o paciente exibindo leve esforço expiratório e taquipneico ao exercício.
Permaneceu por mais 24h na internação mantendo parâmetros fisiológicos estáveis (saturação entre 93%-94%) sem necessidade de suporte de oxigênio e foi liberado para casa, totalizando 10 dias de tratamento hospitalar.
Agora estabilizado, no paciente foi realizada tomografia computadorizada de tórax que evidenciou falha no trajeto da artéria pulmonar direita nos lobos caudal e acessório e da artéria pulmonar esquerda na região do tronco pulmonar, podendo confirmar a suspeita de tromboembolismo pulmonar (TEP).
Posteriormente o paciente foi encaminhado para o pneumologista, que deu seguimento no acompanhamento e tratamento com rivaroxabana.
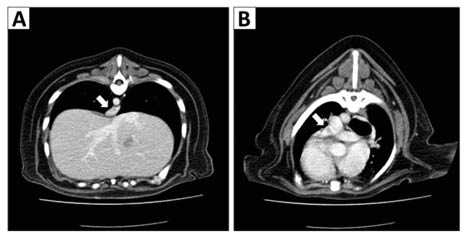
O não preenchimento da artéria pulmonar (setas brancas em A e B) pelo contraste. Fonte: arquivo pessoal.
CONCLUSÃO
Nos cães o diagnóstico do TEP é desafiador, assim como seu manejo. É fundamental o diagnóstico da doença de base associada ao processo, para que seja adequadamente tratada e aumente as chances de sucesso para o paciente.
Embora grave, com os recursos tecnológicos disponíveis para diagnóstico, monitoração e suporte e um melhor entendimento da fisiopatologia, o TEP pode ser manejado e suas consequências tratadas de forma eficiente, trazendo para o paciente qualidade de vida e uma possibilidade de recuperação clínica. Entretanto a evolução é lenta, o que exige hospitalização por longos períodos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. HEANEY. A.M. Tromboembolismo Pulmonar. MAZZAFERRO. E. M. Emergências e cuidados críticos de pequenos Animais. 1 edição ; 2013. pp 685 a 690.
2. FADEL.L. Tromboembolismo Pulmonar. RABELO.R. Emergências de Pequenos Animais, condutas clinicas e cirúrgicas no paciente grave. 1 edição; 2013 pp 1119 a 112
3.ALVARES, F; DE PÁDUA, A.I; FILHO, J.T; Tromboembolismo Pulmonar: Diagnóstico e Tratamento. Simpósio: Urgências e emergências respiratórias 36 da faculdade de Medicina de Ribeirão Preto. Abr/dez 2003. Pp 214-240.
4. GOGGS, R; BENIGNI, L; FUENTES; V.L; CHAN; D.L; Pulmonary Thromboembolism. Journal of Veterinary Emergency and Critical Care, 19(1). 2009; pp 30- 52.
5. NELSON, O. LYNNE ; ANDREASEN, C. The Utility of Plasma D-dimer to Identify Thromboembolic Disease in Dogs; Journal Of Veterinary of internal medicine. 2003 ed 17; pp 830ª 834
6. DE MONYÉ, W., SANSON, B. J., GILAVRY, M. R. MAC, PATTYNAMA, P. M. T.,BÜLLER, H. R., VAN DEN BERG-HUYSMANS, A. a., & HUISMAN, M. V. (2002). Embolus location affects the sensitivity of a rapid quantitative D-dimer assay in the diagnosis of pulmonary embolism. American Journal of Respiratory and Critical Care Medicine, 165(3), 345–348.
7. LISCIANDRO; G.R; PUCHOT, M.L; GAMBINO, J.M; LISCIANDRO S.C; The Wedge Sign: A possible lung ultrasoung sign for pulmonar thromboembolism. Journal of Veterinary Emergency and critical care, Vol 32. Sep/out 2022. Pages 663-669.
8. SOARES. J.F. Piroplasmoses. Tratado de Medicina Interna de Cães e Gatos. JERICÓ, M.M; ANDRADE NETO, J.P; KOGIKA M.M; 1ª edição, 2015. Pag 2277- 2315.
9. DASTE, T; LUCAS, M.N; AUMANN, M.;Cerebral babesiosis and acute respiratory distress syndrome in a dog; Journal of Veterinary Emergency and Critical Care, 23(6). 2013; pp 615- 623.
10. ALMEDROS,A; BURCHELL, R; Multiple complications in a dog infected with Babesia gibsoni. Vet.Rec Case Reports; 2021 el 26. British Veterinjry Association 2021.

Adriana Fragoso Miglioli Visibelli
Médica veterinária, pós-graduada em Medicina Intensiva pela ANCLIVEPA-SP. São Paulo – SP. Email: [email protected] * Autor para correspondência

Fernando Luiz Zanoni
Médico Veterinário, Doutor em Anestesiologia e pós-doutorado em Cirurgia cardíaca pela Faculdade de Medicina da Universidade de São Paulo. São Paulo – SP.
{PAYWALL_FIM}
