Por Thomas A. Trein, Lucas M. Colomé e Nathan J. Noschang
Anestesia intravenosa total (tiva) para craniectomia em um canino: relato de caso
TOTAL INTRAVENOUS ANESTHESIA (TIVA) FOR CRANIECTOMY IN A DOG: CASE REPORT
INTRODUÇÃO
Pacientes veterinários portadores de doenças neurológicas podem necessitar ser submetidos à anestesia tanto para procedimentos diagnósticos como tratamentos cirúrgicos. Ainda mais, não é incomum pacientes que sofrem de alterações neurológicas, como crises epiléticas, hidrocefalia e doença do disco intervertebral, serem anestesiados para outros procedimentos cirúrgicos não relacionados diretamente com o sistema nervoso1,2.
{PAYWALL_INICIO}
Sabe-se que determinados fármacos utilizados rotineiramente, assim como algumas técnicas de anestesia, podem afetar a hemodinâmica, metabolismo do sistema nervoso e o quadro neurológico do paciente3,2. Dentre os grandes desafios de anestesiar estes pacientes está a manutenção do equilíbrio da perfusão sanguínea cerebral e pressão intracraniana (PIC). Desta maneira, o protocolo e manejo anestésico devem ser cautelosamente selecionados para abranger as necessidades individuais de cada paciente e minimizar os efeitos deletérios sobre o sistema nervoso, evitando o aumento da morbidade neurológica durante e após o ato anestésico. O presente artigo tem como objetivo de relatar o procedimento anestésico sob anestesia intravenosa total (TIVA) em um paciente canino submetido à cranioplastia para exérese de um osteoma.
RELATO DE CASO
Uma cadela da raça Shih Tzu de um ano e nove meses de idade, pesando 6,3 quilos foi encaminhada para realização de craniectomia e cranioplastia com malha de titânio. O referido paciente havia iniciado com crises epiléticas sem outra alteração neurológica aparente há pelo menos dois meses. Durante o atendimento de um colega veterinário, notou-se aumento de volume em região frontoparietal direita que após o raio x, concluiu-se tratar de uma proliferação óssea de formato arredondado com aproximadamente 3 cm de diâmetro. Diante do achado, encaminhou-se o paciente para avaliação especializada e possibilidade de craniectomia e cranioplastia. Para continuidade do tratamento, optou-se pela realização de biopsia cirúrgica da lesão a fim de melhor planejar o tamanho da ressecção da calota craniana, tendo por base a necessidade de margens de segurança mais amplas em caso de eventual neoplasia maligna. Posteriormente, diante do resultado histopatológico de osteoma, planejou-se a cirurgia com o auxílio de tomografia e confecção de modelo 3D em tamanho real.
No momento do procedimento cirúrgico, a paciente estava sob tratamento por via oral com dipirona, ranitidina, tramadol e gardenal, e em jejum alimentar e hídrico de oito e duas horas, respectivamente. Exames laboratoriais de hemograma (hematócrito 53%, hemoglobina 18,9 g/dL, leucócitos totais 9.100/μL, plaquetas 470.000/μL) e bioquímicos (creatinina 0,72 mg/dL, ureia 29,0 mg/dL, alanina aminotransferase 95,8 UI/L, fosfatase alcalina 45,6 UI/L e glicemia 126 mg/dL) foram observados dentro dos valores de normalidade para a espécie, assim como os parâmetros vitais ao exame físico, com a exceção da frequência cardíaca avaliada em 220 batimentos por minuto, provavelmente devido à ansiedade do paciente.
Após a avaliação, a veia cefálica foi assepticamente puncionada com cateter 22G para administração dos fármacos e fluidoterapia (solução de Ringer com Lactato, 3 mL/kg/h). Como medicação pré-anestésica, administrou-se metadona 0,2 mg/kg pela via intramuscular (IM), seguido de manitol 0,5 g/kg em aproximadamente 15 minutos e ampicilina 20 mg/kg, ambos por via intravenosa (IV). Posteriormente, a paciente foi pré-oxigenada via máscara facial com oxigênio à 100% em fluxo de 3 L/min por três minutos e submetida à indução anestésica com propofol 1 mg/kg, seguido de fentanil 1 μg/kg, lidocaína 1 mg/kg e propofol 2,5 mg/kg IV até obter relaxamento suficiente para permitir intubação orotraqueal com tubo 4,0 sem apresentar reflexo de tosse. Imediatamente após a indução, a paciente foi conectada a um circuito anestésico não-reinalatório de Baraka com fluxo de 1 L/min de oxigênio à 100%. Ato contínuo, administrou-se dexmedetomidina 1 μg/kg IV e procedeu-se o início da TIVA via infusão contínua inicial de propofol 0,5 mg/kg/min, fentanil 4 μg/kg/h, lidocaína 10 μg/kg/min e dexmedetomidina 1 μg/kg/h através de bombas de seringa de alta precisão (DigiPump SR81x, Digicare Animal Health, Rio de Janeiro, Brasil) (FIGURA 1), quando então iniciou-se o procedimento cirúrgico (FIGURA 2).

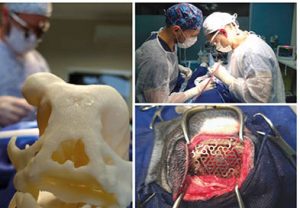
Durante o procedimento anestésico, foram analisados via monitor multiparamétrico (IMEC-8, Mindray, Shenzen, China), frequência cardíaca (FC) e saturação periférica de hemoglobina (SpO2) através de sensor posicionado na língua, frequência respiratória (f) e pressão parcial de dióxido de carbono ao final da expiração (ETCO2) através de capnógrafo side-stream, temperatura esofágica (ToC), eletrocardiograma (ECG), e pressões arteriais sistólica (PAS) e média (PAM) por oscilometria. Adicionalmente, a PAS foi monitorada através de doppler ultrassônico (811-B, Parks Medical, Aloha, USA) com manguito colocado proximal ao carpo. A paciente foi posicionada em decúbito esternal e foi realizada a antissepsia para início do procedimento cirúrgico de craniectomia e cranioplastia com malha de titânio.
Durante o ato anestésico, a paciente permaneceu estável e sob plano anestésico adequado para o procedimento, permitindo a redução gradativa da infusão de propofol para 0,4 mg/kg/min e posteriormente para 0,3 mg/kg/min após 45 e 160 minutos de anestesia, respectivamente. A paciente se manteve sob ventilação assistida, com o intuito de manter a normocapnia (35-45 mmHg), não havendo intercorrências anestésicas ou necessidade de resgates analgésicos. Para auxiliar na manutenção da temperatura corpórea, um tapete térmico elétrico foi empregado. Os parâmetros ao longo do procedimento estão representados na FIGURA 3.
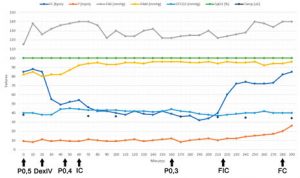
A infusão contínua de fentanil, dexmedetomidina e lidocaína foi encerrada 60 minutos e a infusão de propofol foi encerrada cinco minutos previamente o término do ato cirúrgico. O tempo total de cirurgia e anestesia foram 218 e 285 minutos, respectivamente, e a paciente extubou suavemente e sem complicações nove minutos após o término do procedimento cirúrgico. Como protocolo analgésico pós-operatório imediato, a paciente recebeu dexametasona 0,25 mg/kg IV, metadona 0,2 mg/kg IV e dipirona 25 mg/kg IV.
DISCUSSÃO
O conhecimento da influência da anestesia sobre o fluxo sanguíneo cerebral (FSC) e taxa de metabolismo cerebral (CMRO2) é importante para prevenir danos cerebrais secundários4.Em medicina humana, procedimentos eletivos em neurocirurgia apresentam maior incidência de complicações pós-operatórias, enquanto não-eletivos possuem taxas ainda maiores de complicações e mortalidade5. Dentre os objetivos da anestesia no paciente neurológico com alterações cerebrais estão a otimização do FSC e a prevenção do aumento da PIC1.
O cérebro possui uma alta taxa metabólica e, consequentemente, o FSC deve corresponder a sua demanda.O fluxo sanguíneo para o cérebro é determinado pela pressão de perfusão cerebral (PPC) e resistência vascular cerebral (RVC), os quais são mantidos pela autorregulação, CMRO2, pressões arteriais de dióxido de carbono (PaCO2) e de oxigênio (PaO2) e pressão venosa central (PVC), conforme descrito na literatura1,3.Outros fatores, como fármacos anestésicos e vasoativos, viscosidade sanguínea, temperatura, crises epiléticas e pressão arterial podem afetar o FSC. A autorregulação do FSC se dá através do controle intrínseco do tônus vascular cerebral, mantendo o fluxo sanguíneo para o cérebro relativamente constante mesmo com variações de 60 a 140 mmHg de pressão arterial média e de PPC. Por sua vez, a PPC é a diferença da pressão arterial média (PAM) e a pressão intracraniana, onde o aumento da PIC deve ser acompanhado do aumento da PAM para manter a PPC constante. Assim, aumentos de PIC ou diminuições de PAM significativos podem resultar em isquemia cerebral por diminuição da PPC1,3.
Apesar de ser incomum sua mensuração em medicina veterinária, o rápido aumento da PIC, como em casos de traumatismo craniano, hemorragia subaracnóidea e tumores intracranianos, é indicado pela hipertensão arterial, bradicardia e respiração irregular, denominado de reflexo, tríade ou resposta de Cushing6-8.Pacientes instáveis devem ser estabilizados previamente à anestesia1.O presente paciente encontrava-se estabilizado clinicamente e não apresentou sinais de reflexo de Cushing previamente a indução anestésica ou durante o procedimento cirúrgico. Entretanto, o paciente recebeu preventivamente o manitol, uma vez que a massa tumoral ao pressionar o parênquima cerebral, poderia aumentar a PIC. Em pacientes com barreira hemato-encefálica (BHE) intacta, esse fármaco reduz a PIC através do aumento da osmolaridade plasmática, resultando em movimento de água do espaço intracelular e intersticial cerebral para a circulação sistêmica, além de causar vasoconstrição cerebral e diminuição da produção de fluído cérebro-espinhal1,9-12.Assim como realizado no presente relato, o paciente deve ser posicionado de maneira que previna a flexão do pescoço e mantém a drenagem adequada do sangue venoso oriundo da cabeça, evitando elevações da PIC3.
Agentes anestésicos afetam a dinâmica da vasculatura cerebral através de efeitos diretos, além de modular mecanismos regulatórios endógenos. Da mesma maneira, alguns fármacos apresentam propriedades neuroprotetoras, os quais alteram o equilíbrio da oferta e utilização de oxigênio cerebral de maneira favorável, também podendo prolongar a sobrevivência neuronal durante a isquemia13.Os anestésicos inalatórios aumentam o FSC e diminuem o CMRO2 resultando em vasodilatação devido à ação sobre a vasculatura e diminuição do fluxo sanguíneo devido à diminuição do metabolismo, respectivamente. No emprego de concentrações superiores à 1 concentração alveolar mínima (CAM), os vasos sanguíneos cerebrais dilatam, causando aumento do FSC e possivelmente aumento da PIC1,3,14-17. Por outro lado, agentes inalatórios podem apresentar efeitos neuroprotetores, como redução de lesões durante reperfusão após privação de oxigênio, proteção à longo prazo contra isquemia e atividade anti-excitotóxica18-22. Portanto, recomenda-se aplicar concentrações inferiores à 1 CAM, através do emprego da anestesia multimodal e analgesia balanceada, assim diminuindo o requerimento do agente inalatório e seus efeitos sobre o FSC.
Uma alternativa ao uso de agentes inalatórios é a indução e manutenção da anestesia empregando-se a anestesia intravenosa total (TIVA) por meio do uso de propofol e outros fármacos sedativos e analgésicos23-26. O propofol potencializa a atividade de receptores GABAA, inibe o receptor NMDA, modula canais de cálcio e causa diminuição do FSC e CMRO2, além de apresentar outros efeitos neuroprotetores27-31.O uso do propofol demonstrou diminuir o tamanho do infarto neuronal após isquemia, efeitos antioxidantes, supressão da produção de substâncias inflamatórias após hipóxia além de proteção multimodal30-36. A TIVA tem sido sugerida como o protocolo preferido em pacientes com alterações a nível cerebral, apresentando anestesia estável e satisfatória para craniotomia em cães24,37-38, assim como ocorreu com o paciente do presente relato. Entretanto, um estudo de coorte em humanos submetidos à cranioplastia não identificou influências do uso de propofol ou agente inalatório sobre incidência de complicações pós-operatórias ou grau de edema cerebral intraoperatório39.
A infusão de fármacos analgésicos e sedativos durante o procedimento cirúrgico pode proporcionar analgesia, recuperação anestésica suave, sedação ao despertar, diminuição de requerimento anestésico de manutenção e maior estabilidade hemodinânica3,40-47, além de oferecer efeitos neuroprotetores. O manejo da dor no paciente neurológico é essencial, uma vez que auxilia no controle da pressão arterial, perfusão e oxigenação cerebral e reduz a PIC1,3,48. Os opioides proporcionam analgesia potente, seus efeitos são reversíveis e apresentam mínimos efeitos sobre o FSC, PIC e CMRO2, e por isso são geralmente recomendados13,49,50. Entretanto, deve-se levar em conta seus efeitos adversos como hipotensão arterial, bradicardia e hipoventilação, especialmente quando doses elevadas são empregadas41,51-54. O fentanil apresenta curto período de latência, rápida recuperação, efeito analgésico potente, sendo geralmente administrado por infusão contínua40,50,55,56. Ainda mais, o fentanil apresenta concentração plasmática estável em infusões contínuas de até quatro horas57. No presente relato, o paciente recebeu a infusão de fentanil por aproximadamente 3 horas e 45 minutos e foi mantido sob ventilação assistida durante o ato anestésico para prevenir a hipercapnia, porém, não apresentou sinais de depressão respiratória durante a recuperação anestésica. Uma alternativa ao fentanil seria o uso do remifentanil, o qual é rapidamente metabolizado por esterases plasmáticas e pode ser infundido por longas durações, uma vez que não apresenta alterações farmacocinéticas relacionadas à meia vida contexto sensitiva58,59.No caso em questão, o remifentanil não estava disponível para uso no momento do procedimento.
A lidocaína é um fármaco anestésico local do tipo amida e possui efeitos analgésicos, antiarritmicos e anti-inflamatórios60,61. Apesar de não apresentar diminuição do requerimento de propofol durante a indução ou manutenção anestésica, nem atenuação da depressão cardiovascular causada pela infusão de propofol 42,62,63, a lidocaína reduz a incidência de tosse durante a intubação, a qual pode elevar a PIC2,62,64. A dexmedetomidina atua como agonista de receptores agonistas α2 adrenérgicos altamente seletivo e promove sedação, analgesia e diminuição de requerimento anestésico44,65,66.Em contrapartida, mesmo em taxas baixas, a dexmedetomidina resulta em vasoconstrição, bradicardia e diminuição do débito cardíaco, sendo contraindicada em pacientes com instabilidade hemodinâmica43,67-69. Entretanto, a pressão arterial e perfusão tecidual global se mantém dentro dos limites normais70. Adicionalmente, a dexmedetomidina apresenta mínimo efeito sobre a PIC e uma leve redução do FSC, possivelmente devido à vasoconstrição cerebral ou supressão da CMRO21,3,15,71-73.
Além da monitoração básica, como eletrocardiograma, temperatura e oximetria de pulso, outros parâmetros devem ser atentamente supervisionados. Em pacientes com alterações neurológicas com suspeita de aumento de PIC, o controle da ventilação para evitar tanto a hipercapnia como a hipocapnia são cruciais para prevenir morbidade e mortalidade1,3. O aumento da PaCO2 rapidamente afeta o FSC, diminuindo o pH do líquido cérebro-espinhal, resultando em vasodilatação cerebral e aumento da PIC. Portanto, sugere-se manter a normocapnia ou leve hipocapnia, com valores de PaCO2 próximos a 30-35 mmHg. No entanto, apesar da hiperventilação ser uma das maneiras mais efetivas de reduzir a PIC através da diminuição do FSC, a hipocapnia excessiva pode resultar em isquemia cerebral1, 74-77. Da mesma maneira, o ato da oxigenação previamente a indução anestésica minimiza a hipoxemia e deve ser realizada sem estresse. A hipóxia cerebral é um fator potente que aumenta o FSC secundário ao desenvolvimento de acidose metabólica78. A monitoração da pressão arterial durante a anestesia também é essencial, uma vez que a hipotensão pode resultar em diminuição da PPC e isquemia cerebral3,8. No presente relato, o paciente manteve estabilidade dos parâmetros cardiovasculares durante o procedimento cirúrgico, apresentando a bradicardia esperada após a administração do bolus de dexmedetomidina e durante a infusão da mesma, apesar de manter a pressão arterial estável, sem evidenciar hipotensão. Ainda mais, manteve-se a normocapnia através da ventilação assistida, almejando manter valores de ETCO2 próximos ao limite inferior de 35-45 mmHg.
CONCLUSÃO
A anestesia intravenosa total empregando o propofol, lidocaína, fentanil e dexmedetomidina, associada à ventilação assistida, proporcionou analgesia multimodal e estabilidade cardiorrespiratória durante a craniotomia e cranioplastia, podendo ser uma alternativa de protocolo de anestesia balanceada em pacientes com neoplasias cranianas. A anestesia em pacientes com alterações neurológicas deve levar em consideração a patofisiologia da alteração, além dos efeitos dos fármacos e técnicas anestésicas sobre a hemodinâmica cerebral. A fim de diminuir complicações, a seleção criteriosa dos fármacos anestésicos e adjuntos deve estar associada à monitoração constante e suporte ventilatório, especialmente em pacientes com risco de pressão intracraniana elevada.
REFERÊNCIAS BIBLIOGRÁFICAS
1WENDT-HORNICKLE, E. Neurologic Disease. In: SNYDER, L.B.C.; JOHNSON, R.A. Canine and Feline anesthesia and co-existing disease. 1. ed. Iowa: John Wiley & Sons, 2015, p. 71-81.
2 LEECE, E.A. Neurological disease. In: DUKE-NOVAKOVSKI, T.; de VRIES, M.; SEYMOR, C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. 3. ed., Gloucester: British Small Animal Veterinary Association, 2016, p. 392-408.
3 GREENE, S.A. Anesthesia for Patients with Neurologic Disease. Topics in Companion Animals, v. 25, n. 2, 2010, p. 83-86.
4 WAELBERS, T. et al. Brain perfusion part 2: anesthesia and brain perfusion in small animals. Vlaams Diergenees kundig Tijdschrift, v. 79, p. 179-188, 2010.
5 SIQUEIRA, E.M.P.; DICCINI, S. Postoperative complications in elective and non-elective neurosurgery. Acta Paulista de Enfermagem, 2017; 30 (1), p. 101-108.
6 FODSTADT, H.; KELLY, P.J.; BUCHFELDER, M. History of the Cushing Reflex. Neurosurgery, v. 59, p. 1132-1137, 2006.
7 OTTO, K.A. Physiology, Pathophysiology, and Anesthetic Management of Patients with Neurologic Disease. In: GRIMM, K.A. et al. Veterinary Anesthesia and Analgesia. 5. ed., Iowa: John Wiley & Sons, 2015. P.259-283.
8 PASTERNAK, J.J.; LANIER, W.L. Neuroanesthesiology update 2010. Journal of Neurosurgical Anesthesiology, v. 23, p. 67-69, 2011.
9 BAGLEY, R.S. et al. Intraoperative monitoring of intracranial pressure in five dogs with space-occupying intracranial lesions. Journal of the American Veterinary Medical Association, v. 207, n. 5, p. 588-591, 1995.
10 ROSNER, M.J.; COLEY, I. Cerebral perfusion pressure: a hemodynamic mechanism of mannitol and the post-mannitol hemogram. Neurosurgery, 21, p. 147-156, 1987.
11 HARTWELL, R.C.; SUTTON, L.N. Mannitol, intracranial pressure, and vasogenic edema. Neurosurgery, 32, p. 444-450, 1993.
12 DONATO, T. et al. Effect of mannitol on cerebrospinal fluid dynamics and brain tissue edema. Anesthesia and Analgesia, v. 78, n. 1, p. 58-66, 1994.
13 SLUPE, A.M.; KIRSCH, J.R. Effects of anesthesia on cerebral blood flow, metabolism, and neuroprotection. Journal of Cerebral Blood Flow & Metabolism, v. 38, n. 12, p. 2192-2208, 2018.
14 TODD, M.M.; DRUMMOND, J.C. A comparison of the cerebrovascular and metabolic effects of halothane and isoflurane in the cat. Anesthesiology, v. 60, p. 276-282, 1984.
15 DRUMMOND, J.C. et al. A comparison of the direct cerebral vasodilating potencies of halothane and isoflurane in the New Zealand white rabbit. Anesthesiology, v. 65, p. 462-468, 1986.
16 DRUMMOND, J.C.; PATEL, P.M. Cerebral physiology and the effects of anesthetics and techniques. In: MILLER, R.D. Miller’s Anesthesia. 5. ed., Philadelphia: Churchill Livingstone, 2000, p. 695-733.
17 SCHELLER, M.S. et al. Cerebral effects of sevoflurane in the dog: comparison with isoflurane and enflurane. British Journal of Anesthesia, v. 65, n. 3, p. 388-392, 1990.
18 LEE, J.J. et al. Postconditioning with Isoflurane Reduced Ischemia-induced Brain Injury in Rats. Anesthesiology, v. 108, p. 1055-1062, 2008.
19 ENGELHARD, K. et al. Desflurane and isoflurane improve neurological outcome after incomplete cerebral ischaemia in rats. British Journal of Anaesthesia, v. 83, n. 3, p. 415-421, 1999.
20 ERDEM, A.F. et al. Effects of sevoflurane and desflurane in CA1 after incomplete cerebral ischemia in rats. Saudi Medical Journal, v. 26, n. 9, p. 1424-1428, 2005.
21 LUO, Y. et al. Xenon and Sevoflurane Protect against Brain Injury in a Neonatal Asphyxia Model. Anesthesiology, v. 109, p. 782-789, 2008.
22 CANAS, P.T. et al. Sevoflurane Protects Rat Mixed Cerebrocortical Neuronal-Glial Cell Cultures Against Transient Oxygen-Glucose Deprivation: Involvement of Glutamate Uptake and Reactive Oxygen Species. Anesthesiology, v. 105, p. 990-998, 2006.
23 ENGELHARD, K.; WERNER, C. Inhalational or intravenous anesthetics for craniotomies? Pro inhalational. Current Opinion in Anaesthesiology, v. 19, n. 5, p. 504-508, 2006.
24 HANS, P.; BONHOMME, V. Why we still use intravenous drugs as the basic regimen for neurosurgical anaesthesia. Current Opinion in Anaesthesiology, v. 19, n. 5, p. 498-503, 2006.
25 MARTINEZ, M. Anaesthetic management of dogs and cats with an intracranial mass. Vet Times. Disponível em: www.vettimes.co.uk/article/anaesthetic-management-of-dogs-and-cats-with-an-intracranial-mass/. Acesso em: 10 de out. 2022.
26 KOTSIDOU, M.; TSITSILIANOU, A.; KAZAKOS, G. Anaesthetic management of dogs and cats with intracranial pathology (brain injury, tumours, seizures). Hellenic Journal of Companion Animal Medicine, v. 10, n. 2, p. 120-136, 2022.
27 YIP, G.M. et al. A propofol binding site in the mammalian GABAA receptors identified by photolabeling. Nature Chemical Biology, v. 9, p. 715-720, 2013.
28 JURD, R. et al. General anesthetic actions in vivo strongly attenuated by a point mutation in the GABA(A) receptor beta3 subunit. Federation of American Societies for Experimental Biology Journal, v. 17, p. 250-252, 2003.
29 ADEMBRI, C. et al. Neuroprotective effects of propofol in models of cerebral ischemia: inhibition of mitochondrial swelling as a possible mechanism. Anesthesiology, v. 104, p. 80-89, 2006.
30 BAYONA, N.A. et al. Propofol neuroprotection in cerebral ischemia and its effects on low molecular-weight antioxidants and skilled motor tasks. Anesthesiology, v. 100, p. 1151-1159, 2004.
31 KOTANI, Y. et al. The experimental and clinical pharmacology of propofol, an anesthetic agent with neuroprotective properties. CNS Neuroscience & Therapeutics, v. 14, p. 95-106, 2008.
32 COYLE, J.T.; PUTTFARCKEN, P. Oxidative stress, glutamate, and neurodegenerative disorders. Science, v. 262, p. 689-695, 1993.
33 KUBO, K.; INADA, T.; SHINGU, K. Possible role of propofol’s cyclooxygenase-inhibiting property in alleviating dopaminergic neuronal loss in the substantia nigra in an MPTP-induced murine model of Parkinson’s disease. Brain Research, v. 1387, p. 125-133, 2011.
34 GUI, B. et al. Neuroprotective effects of pretreatment with propofol in LPS-induced BV-2 microglia cells: role of TLR4 and GSJ-3beta. Inflammation, v. 35, p. 1632-1640, 2012.
35 ADEMBRI, C.; VENTURI, L.; PELLEGRINI-GIAMPIETRO, D.E. Neuroprotective Effects of Propofol in Acute Cerebral Injury, CNS Drug Reviews, v. 13, n. 3, p. 333-351, 2007.
36 FAN, W. et al. Propofol: an anesthetic possessing neuroprotective effects. European Review for Medical and Pharmacological Sciences, v. 19, p. 1520-1529,2015.
37 RAISIS, A.L. et al. Evaluation of an anesthetic technique used in dogs under going craniectomy for tumour resection. Veterinary Anaesthesia and Analgesia, v. 34, n. 3, p. 171-180, 2007.
38 SCHIFILLITI, D. et al. Anaesthetic-Related Neuroprotection. Intravenous or Inhalational Agents? CNS Drugs, v. 24, n. 1, p. 893-907, 2011.
39 GRAU, S. et al. The Choice of the hypnotic drug (volatile or propofol) for maintenance of anesthesia does not influence surgical conditions during cranioplasty. Journal of Anaesthesiology, Clinical Pharmacology, v. 34, n. 2, p. 172-176, 2018.
40 ZOFF, A.; BRADBROOK, C. Constant rate infusions in small animal practice. Companion Animal, v. 21, n. 9, p. 516-522, 2016.
41 LIEHMANN, L.; MOSING, M.; AUER, U. A comparison of cardiorespiratory variables during isoflurane-fentanyl and propofol-fentanyl anesthesia for surgery in injured cats. Veterinary Anaesthesia and Analgesia, v. 33, p. 158-168, 2006.
42 MANNARINO, R. et al. Minimum infusion rate and hemodynamic effects of propofol, propofol-lidocaine and propofol-lidocaine-ketamine in dogs. Veterinary Anaesthesia and Analgesia, v. 39, n. 2. P. 160-173, 2012.
43 DUKE, T. Partial intravenous anesthesia in cats and dogs. Canadian Veterinary Journal, v. 54, p. 276-282, 2013.
44 SMITH, C.K. et al. Effect of dexmedetomidine on the minimum infusion rate of propofol preventing movement in dogs. Veterinary Anaesthesia and Analgesia, v. 44, n. 6, p. 1287-1295, 2017.
45 DAVIS, C.A. et al. Effect of fentanyl on the induction dose and minimum infusion rate of propofol preventing movement in dogs. Veterinary Anaesthesia and Analgesia, v. 44, n. 4, p. 727-737, 2017.
46 MONZEM, S. et al. Total intravenous Anesthesia with Propofol Associated with Fentanyl, Lidocaine or Ketamine in Bitches Submitted to Elective Ovariohysterectomy. Acta Scientiae Veterinariae, v. 45, n. 1, p. 6,2017.
47 BOFF, G.A. et al. Total intravenous anesthesia with propofol and dexmedetomidine in bitches submitted to ovary-hysterectomy. Research, Society and Development, v. 11, n. 5, p. e25411528004, 2002.
48 DOS SANTOS, L.O. et al. Traumatic brain injury in dogs and cats: a systematic review. Veterinárni Medícina, v. 63, p. 345-357, 2018.
49 WANG, X. Neuroprotective effects and mechanisms of fentanyl preconditioning against brain ischemia. Critical Care, v. 10, suplem. 1, p. 446, 2006.
50 KUKANICH, B.; WIESE, A.J. Opioids. In: GRIMM, K.A. et al. Veterinary Anaesthesia and Analgesia, ed. 5, Iowa: John Wiley & Sons, 2015, p. 207-226.
51 BUFALARI, A. et al. Fentanyl or sufentanil in continuous infusion during isoflurane anaesthesia in dogs: clinical experiences. Veterinary Research Communications, v. 31, p. 277, p. 2007.
52 ROBERTS, D.; HALL, R.; KRAMER, A. Sedation for critically ill adults with severe traumatic brain injury: a systematic review of randomized controlled trials. Critical Care Medicine, v. 39,p. 2743-2751, 2007.
53 CEREJO, S.A. et al. Effects of constant rate infusion of anesthetic or analgesic drugs on general anesthesia with isoflurane: A retrospective study in 200 dogs. Semina: Ciências Agrárias, v. 34, n. 4, p. 1807-1822, 2013.
54 BEIER, S.L. et al. Hemodynamic effects of target-controlled infusion of propofol alone or in combination with a constant-rate infusion of remifentanil in dogs. Canadian Journal of Veterinary Research, v. 79, n. 4, p. 309-315, 2015.
55IIZUKA, T.; NISHIMURA, R. Context-sensitive half-time of fentanyl in dogs. The Journal of Veterinary Medicine, v. 77, n. 5, p. 615-617, 2015.
56AMENGUAL, M.; LEIGH, H.; RIOJA, E. Postoperative respiratory effects of intravenous fentanyl compared to intravenous methadone in dogs following spinal surgery. Veterinary Anaesthesia and Analgesia, v. 44, n. 5, p. 1042-1048, 2017.
57 SANO, T. et al. Pharmacokinetics of fentanyl after a single intravenous injection and constant rate infusion in dogs. Veterinary Anaesthesia and Analgesia, v. 33, n. 4, p. 266-273, 2006.
58 GLASS, P.S. et al. Preliminary pharmacokinetics and pharmacodynamics of an ultra-short-acting opioid: remifentanil (GI87084B). Anesthesia and Analgesia, v. 77, n. 5, p. 1031-1040, 1993.
59 PITSIU, M. et al. Pharmacokinetics of remifentanil and its major metabolite, remifentanil acid, in ICU patients with renal impairment. British Journal of Anaesthesia, v. 92, n. 4, p. 493-503, 2004.
60 LAURETTI, G.R. Mechanisms of analgesia of intravenous lidocaine. Revista Brasileira de Anestesiologia, v. 58, p. 280-286, 2008.
61 ORTEGA, M.; CRUZ, I. Evaluation of a constant rate infusion of lidocaine for balanced anesthesia in dogs undergoing surgery. Canadian Veterinary Journal, v. 52, n. 8, p. 856-860, 2011.
62 PANTI, A.; CAFRITA, I.C.; CLARK, L. Effect of intravenous lidocaine on cough response to endotracheal intubation in propofol-anaesthetized dogs. Veterinary Anaesthesia and Analgesia, v. 43, p. 405-411, 2016.
63 CERASOLI, I. et al. The effects of intravenous lidocaine before propofol induction in premedicated dogs. Journal of Small Animal Practice, v. 57, n. 8, p. 435-440, 2016.
64MCNALLY, E.M. ROBERTSON, S.A.; PABLO, L.S. Comparison of time to desaturation between preoxygenated and non-preoxygenated dogs following sedation with acepromazine maleate and morphine and induction of anesthesia with propofol, American Journal of Veterinary Research, v. 70, n. 11, p. 1333-1338, 2009.
65 KUUSELA, E. et al. Sedative, analgesic, and cardiovascular effects of levomedetomidine alone and in combination with dexmedetomidine in dogs. American Journal of Veterinary Research, v. 62, n. 4, p. 616-621, 2001.
66 PASCOE, P.J. et al. Changes in the minimum alveolar concentration of isoflurane and some cardiopulmonary measurements during three continuous infusion rates of dexmedetomidine in dogs. Veterinary Anaesthesia and Analgesia, v. 33, p. 97-103, 2006.
67P YPENDOP, B.H.; VERSTEGEN, J.P. Hemodynamic effects of medetomidine in the dog: A dose titration study. Veterinary Surgery, v. 27, p. 612-622, 1998.
68 MURRELL, J.C.; HELLEBREKERS, J.H. Medetomidine and dexmedetomidine: a review of cardiovascular effects and antinociceptive properties in the dog. Veterinary Anaesthesia and Analgesia, v. 32, p. 117-127, 2005.
69 CARTER, J.E. et al. The haemodynamic effect of medetomidine continuous rate infusions in the dog. Veterinary Anaesthesia and Analgesia, v. 37, p. 197-206, 2010.
70 UILENREEF, J.J. et al. Dexmedetomidine continuous rate infusion during isoflurane anaesthesia in canine surgical patients. Veterinary Anaesthesia and Analgesia, v. 35, p. 1-12, 2008.
71ZORNOW, M.H. et al. Dexmedetomidine decreases cerebral blood flow velocity in humans. Journal of Cerebral Blood Flow and Metabolism, v. 13, p. 350-353, 1993.
72 MCPHERSON, R.W. et al. Intraventricular dexmedetomidine decreases cerebral blood flow during normoxia and hypoxia in dogs. Anesthesia and Analgesia, v. 84, p. 139-147, 1997.
73 PRIELIPP, R.C. et al. Dexmedetomidine-induced sedation in volunteers decreases regional and global cerebral blood flow. Anesthesia and Analgesia, v. 95, p. 1052-1059, 2002.
74 JACKSON, R.T.; CLAIRMONT, A.A.; POLLOCK, R.A. The effect of carbon dioxide inhalation on cerebral blood flow: a two-hour duration study in dogs with microspheres. Stroke Journal, v. 5, n. 3, p. 344-349, 1974.
75 DETRE, J.A. et al. Measurement of regional cerebral blood flow in cat brain using intracarotid 2H¬2O and 2H NMR imaging. Magnetic Resonance in Medicine, v. 14, n. 2, p. 389-395, 1990.
76 OERTEL, M. et al. Efficacy of hyperventilation, blood elevation, and metabolic suppression therapy in controlling intracranial pressure after head injury. Journal of Neurosurgery, v. 97, n. 5, p. 1045-1053, 2002.
77 CURLEY, G.; KAVANAGH, B.P.; LAFFEY, J.G. Hypocapnia and the injured brain: more harm than benefit. Critical Care Medicine, v. 38, n. 5, p. 1348-1359, 2010.
78 SHARDLOW, E.; JACKSON, A. Cerebral blood flow and intracranial pressure. Anaesthesia and Intensive Care Medicine, v. 12, n. 5, p. 220-223, 2011.

Thomas Alexander Trein
Médico-veterinário Anestesiologista do Serviço de Anestesiologia Veterinária do Rio Grande do Sul (SAVERS), Porto Alegre, RS; mestre em Ciências Animais; Especialista em Anestesiologia Veterinária pelo Colégio Brasileiro de Anestesiologia Veterinária (CBAV).

Lucas Marques Colomé
Médico-veterinário Neurologista/Neurocirurgião do NEURUM, Porto Alegre, RS; mestre e doutor em Cirurgia; Especializado em Neurologia Veterinária.

Nathan Jobim Noschang
Discente do curso de Medicina Veterinária do Centro Universitário Ritter do Reis (UNIRITTER), Porto Alegre, RS.
{PAYWALL_FIM}