Paulo Fernandes Marcusso (1), Ricardo Andres Ramirez Uscategui(2), Beatriz Gasser(3)
(1)Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista. Botucatu, São Paulo, Brasil (2)Facultad de Medicina Veterinaria y Zootecnia da Universidad CES. Medellín, Antioquia, Colombia (3)Instituto de Ciências Agrárias da Universidade Federal dos Vales do Jequitinhonha e Mucuri, Unaí, Minas Gerias, Brasil
UPDATES ON DEFINITION, IDENTIFICATION AND TREATMENT OF SEPSIS IN VETERINARY MEDICINE
Resumo
A sepse é definida como uma disfunção orgânica com risco de morte causada por uma resposta desregulada do organismo à infecção. Na medicina humana, para pacientes internados em unidades de terapia intensiva (UTI) representa a causa mais importante de mortalidade, com impacto significativo nos custos da assistência à saúde em todo o mundo. Para o reconhecimento precoce da sepse foram desenvolvidos critérios que são rotineiramente utilizados na medicina humana, como os parâmetros da Síndrome da Resposta Inflamatória Sistêmica (SIRS) e quick SOFA (qSOFA), utilizados para triagem e Sequential Sepsis-related Organ Failure Assessment (SOFA) para o diagnóstico. Por meio de um diagnóstico mais rápido e assertivo é possível que a equipe médica consiga entrar com a terapia adequada rapidamente visando a melhora do paciente. Acredita-se que o impacto da sepse seja tão importante para a medicina veterinária como é para a humana, todavia ainda existem poucos estudos sobre ela em animais. Portanto, essa revisão traz algumas atualizações da definição, diagnóstico e tratamento da sepse na medicina veterinária.
{PAYWALL_INICIO}
Palavras-chave: citocinas, diagnós-tico, inflamação, terapêutica.
Abstract
Sepsis is defined as a life-threatening organ dysfunction caused by an unregulated response of the body to infection. In medicine, for patients admitted to intensive care units (ICU), it represents the most important cause of mortality, with a significant impact on health care costs worldwide. For the early recognition of sepsis, criteria that are routinely used in human were developed, such as the parameters of Systemic Inflammatory Response Syndrome (SIRS) and quick SOFA (qSOFA), used for screening and Sequential Sepsis-related Organ Failure Assessment (SOFA) for the diagnosis. The faster and more assertive diagnosis allows the rapid implementation of adequate therapy by the medical team, aiming at the patient’s improvement. It is believed that the impact of sepsis is as important for veterinary medicine as it is for humans, however there are still few studies related to this condition in animals. Therefore, this review brings some updates regarding the definition, diagnosis and treatment of sepsis in veterinary medicine.
Key-words: cytokines, diagnosis, inflammation, therapeutics
A sepse é definida como uma disfunção orgânica com risco de morte causada por uma resposta desregulada do organismo à infecção, que normalmente progride para hipoperfusão de órgãos e morte dentro de horas a dias quando não tratada1,2. Em pacientes internados em unidades de terapia intensiva (UTI) representa a causa mais importante de mortalidade, com impacto significativo nos custos da assistência à saúde em todo o mundo2. Na medicina veterinária, é uma condição que está associada a altas taxas de mortalidade em cães e gatos3.
Mundialmente, mais de 30 milhões de pacientes humanos são diagnosticados com sepse e 5 milhões vêm a óbito3,4. Devido ao seu potencial sistêmico, a sepse possui a capacidade de afetar todo o organismo, especificamente rim, fígado e coração5.
Diversas doenças podem levar à sepse, como peritonite séptica, abscessos hepáticos, piotórax, bacteremia, pneumonia, endocardite, pielonefrite, piometra, pancreatite séptica e meningite. Uma identificação precoce, bem como a instituição de antibioticoterapia apropriada e cuidados intensivos de suporte para a manutenção da perfusão tecidual são elementos cruciais para definição de terapêutica a ser instituída e prognóstico6. Portanto, a utilização de ferramentas que encaminhem ao diagnóstico precoce de sepse está diretamente relacionada ao prognóstico dos animais acometidos.
As principais definições de sepse e os protocolos de conduta médica para diagnóstico e tratamento relacionados aos pacientes sépticos começaram a ser amplamente discutidos em 1991, quando foi realizada a primeira Conferência de Consenso de Sepse, que visou definir os termos empregados para se tratar da doença, introduzir novos conceitos, como o da Síndrome da Resposta Inflamatória Sistêmica (SIRS) e aumentar as chances de diagnósticos concretos e precisos7.
A Síndrome da Resposta Inflamatória Sistêmica (SIRS) é a resposta clínica da reação inflamatória e pode ter causas infecciosas (sepse) ou não infecciosas, como traumas, queimaduras, pancreatite e doenças imunomediadas. As ocorrências clínicas previstas na SIRS incluem alterações na frequência cardíaca (taquicardia ou bradicardia), frequência respiratória (taquipneia), temperatura corporal (febre ou hipotermia) e leucometria, podendo ocorrer tanto leucocitoses quanto leucopenias, comumente com presença de desvios à esquerda. No caso dos felinos, se o paciente apresentar no mínimo três das quatro alterações descritas acima, considera-se um paciente em SIRS, servindo como triagem para pacientes sépticos6.
Outra forma de triagem para pacientes em sepse é o quick SOFA (qSOFA), que é uma versão resumida do Sequential Sepsis-related
Organ Failure Assessment (SOFA). São avaliadas três variáveis clínicas: pressão arterial, frequência respiratória e estado mental, sem demanda de exames laboratoriais. A existência de duas ou mais variáveis do qSOFA sugere um maior risco de mortalidade e alerta os clínicos para os casos mais graves, como é o caso de pacientes sépticos8.
Para o diagnóstico definitivo de sepse é utilizada uma escala com parâmetros clínicos e laboratoriais denominada Sequential Sepsis-related Organ Failure Assessment (SOFA), todavia é aplicada apenas em humanos e foi validada para cães. A SOFA é utilizada para rastrear a sepse em pacientes hospitalizados que apresentem pontuação anormal na Escala de Coma de Glascow, frequência cardíaca, pressão parcial de oxigênio e dióxido de carbono (PaO2 e PaCO2 mmHg), e alterações laboratoriais, como aumento ou diminuição na contagem total de leucócitos, altas dosagens de creatinina e bilirrubina total. Conforme a tabela 1, validada para caninos9.
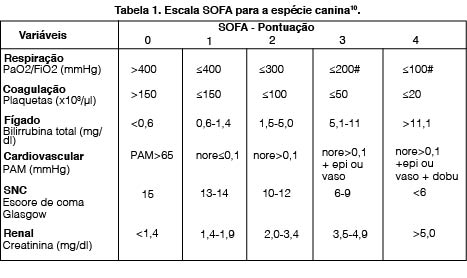
Pacientes com o diagnóstico definitivo de sepse através dessa escala podem evoluir para choque séptico, no qual observa-se, juntamente com as alterações descritas acima, hipotensão arterial persistente, tornando-os dependentes de drogas vasopressoras a fim de manter a pressão arterial maior ou igual a 65 mmHg e lactato sérico > 2 mmol/L, indicativo de hipoperfusão tecidual e está correlacionado com maiores taxas de mortalidade8,9.
Os pacientes com sepse requerem a instauração de um tratamento adequado no menor tempo possível11, este tratamento é baseado em terapias que brindem suporte às funções vitais objetivando, primordialmente, aumentar o aporte de oxigênio aos tecidos e reduzir seu consumo12. Dentre os protocolos terapêuticos propostos até hoje, a terapia guiada em objetivos precoces (EGDT pelas iniciais em inglês de Early Goal Directed Therapy) se considera a mais adequada, pois demonstrou com evidência clínica reduzir a mortalidade em humanos13.
A EGDT na medicina veterinária extrapola a abordagem proposta em humanos com algumas modificações, porém, com limitadíssimos reportes sobre sua evidência científica e clínica.
O manejo clínico atual da sepse se enfoca em combater a causa primária ou detonante desta condição (fonte da infecção) e brindar suporte, ou seja, preservar as funções vitais do organismo, tentando manter a funcionalidade orgânica, até a resolução da sua resposta imune errônea. O tratamento da causa primária é um desafio e pode requerer mais de uma medida terapêutica (p.e. antibióticos, antifúngicos, antivirais, cirurgia etc.). Já a terapia de suporte requer monitorar diversas variáveis clínicas e laboratoriais durante o cuidado crítico destes pacientes, estas variáveis são os objetivos da EGDT e guiam a tomada de decisões terapêuticas por parte do profissional para tentar manter o funcionamento celular11.
A EGDT foi introduzida em 2001 na medicina humana como parte da campanha sobrevivendo a sepse, com estas medidas conseguiram reduzir a mortalidade hospitalar em 16% e em 12% a mortalidade nos primeiros 60 dias13. Protocolos veterinários interpolam esta abordagem e são recomendados para a terapia de suporte e monitoração dos pacientes11,14,15, assim a EGDT tem como objetivos primários, secundários e como medidas terapêuticas:
1. Controle da infecção:
1.1. Diagnóstico etiológico: antes de administrar qualquer medicamento antibiótico ou realizar qualquer intervenção cirúrgica, se recomenda coletar amostras que permitam a identificação do(s) agente(s) causais e sua sensibilidade aos antibióticos.
1.2. Terapia antibiótica: iniciar o tratamento prontamente, a terapia deve ser empírica, de amplo espectro, guiada no histórico epidemiológico infeccioso da região, do tecido afetado e no histórico de resposta antibiótica; a monitorização da resposta aos antibióticos normalmente é clínica, mas a recomendação teórica ideal seria o acompanhamento mediante a mensuração da pró-calcitonina sanguínea.
1.3. Tratamento do foco infeccioso: se a causa da infecção precisa de intervenção cirúrgica proceder assim que seja realizada a estabilização hemodinâmica.
1.4. Controle de infecção secundária: se recomenda troca e higiene de sondas, cateteres e acessos (24h), limpeza com gluconato de clorexidina (12h) da cavidade oral em pacientes sedados, prevenção de úlceras gastrintestinais (inibidores H2 ou da bomba de prótons 12h), prevenção de úlceras de contato mediante movimentação e camas especiais.
2. Manutenção da pressão arterial média (PAM) acima de 65 mmHg sem procurar valores muito altos, ou seja, rondando os 70 ou 80 mmHg.
2.1. A terapêutica inicial no caso de hipotensão consiste nos desafios com cristaloides, nos quais se utilizam cristaloides isotônicos numa taxa de 10 mL/kg em 15 minutos, se monitoriza a resposta em 15 minutos e caso não haja resposta, pode-se tentar novamente, sem exceder 30 mL/kg nas primeiras 3 horas.
2.2. Caso não haja resposta aos desafios com cristaloides, se recomenda a terapia vasopressora, iniciando com norepinefrina com taxas de 0,05 µg/kg/min e aumentando caso necessário até 0,5 µg/kg/min, tentando manter a PAM ± em 65 mmHg. Caso não seja suficiente ou não esteja disponível, pode-se adicionar ou tentar com vasopressina 0,0005 – 0,002 U/kg/min ou epinefrina 0,1 – 0,3 µg/kg/min. Em pacientes com bradiarritmias ou bradicardia absoluta, concomitante, se recomenda utilizar dopamina 5 – 10 µg/kg/min.
2.3. Na ausência de resposta se recomenda realizar coleta de sangue venoso central ou pelo menos jugular, para a mensuração da saturação de oxigênio (SvcO2 ou SvjO2). Caso esta saturação seja menor a 75% ou 70% respectivamente ou se tenha um lactato sanguíneo maior a 3 mmol/L, somado a um hematócrito menor a 20% ou uma hemoglobina sanguínea menor a 7 g/dL, se recomenda a aplicação de produtos sanguíneos para o transporte de oxigênio, primariamente concentrado de eritrócitos e se não está disponível, transfusão de sangue completa no volume necessário para alcançar um hematócrito de aproximadamente 30%.
2.4. Caso não haja resposta nenhuma, se recomenda a administração de dobutamina numa taxa de 1 a 8 µg/kg/min; se a PAM não consegue ser regulada, pode se indicar a aplicação de hidrocortisona 2,5 – 4,0 mg/kg/dia. Não se recomenda o uso de imunoglobulinas, selênio, proteína recombinante ativada nem N-acetil-cisteína.
3. Manutenção da relação PaO2/FiO2 (PaFi) > 300
3.1. Oxigenoterapia: caso haja redução da PaFi se recomenda o tratamento com oxigênio na forma de administração mais simples para o profissional e menos estressante para o paciente, fluxos de 2 a 5 L/min são desejados, via máscara facial ou sonda nasal, por exemplo.
3.2. Ventilação mecânica: caso não haja resposta à terapia de oxigênio o paciente precisará ser sedado e colocado na ventilação mecânica, esta terapia precisa de infraestrutura e preparo profissional muito especializado e deverá ser realizada sob essas condições.
4. Controle glicêmico: a glicemia deverá ser monitorada no sangue arterial (ideal) a cada 4 h, mas caso existam alterações a cada 2 h até seu controle, o objetivo e mantê-la entre 60 e 180 mg/dL em cães e até 250 mg/dL em gatos.
4.1. Caso a glicemia seja ≥ 180 mg/dL em cães ou ≥ 250 mg/dL em gatos, administrar insulina regular (0,05 UI/kg/h) e avaliar potássio sanguíneo.
4.2. Se for ≤ 60 mg/dL: tratar com glicose ao 50% 0,2 mL/kg diluída a 12,5% em água destilada e infusão continua se necessário de glicose 5%.
4.3. Iniciar nutrição enteral hipercalórica o mais cedo possível, monitorar resíduos gástricos para limitar as chances de refluxo, suplementar ômega-3, utilizar agentes pro-cinéticos ou nutrição duodenal em pacientes com alto risco de refluxo e bronco-aspiração, recomenda-se suplementar arginina, mas não se recomenda suplementar carnitina.
5. Manter o débito urinário > 0,5 mL/kg/h
5.1. Se for menor do objetivo e tiver disponível hemodiálise, iniciar esta terapia.
5.2. Caso não esteja disponível, administrar furosemida 0,1-0,5 mg/kg IV segundo efeito.
6. Controle do equilíbrio ácido-básico: realizar as manobras necessárias para corrigir os desequilíbrios resultantes, tanto a nível ácido-básico como eletrolítico.
7. Desfecho e objetivos de controle: manter comunicação aberta, sincera e direta com o tutor, definir com o tutor os objetivos de cuidado, prognóstico e o tempo. Os objetivos terapêuticos devem ser alcançados nas primeiras 72h de cuidado crítico, caso não se obtenha resposta se recomenda planejamento e cuidados paliativos do fim da vida.
Conclusões
A sepse é a maior causa de morte evitável no mundo e leva milhões de pessoas a óbito todos os anos, todavia o conhecimento acerca da sepse na medicina veterinária é escasso. São necessários novos estudos e desenvolvimento de escalas adaptadas as diferentes espécies animais, a fim de possibilitar o reconhecimento precoce da sepse e, portanto, realizar o manejo terapêuticomais assertivo, visando salvar a vida dos pacientes sépticos dentro da medicina veterinária.
Referências
1. RAGHUNATHAN, V.; ZILBERMAN‐RUDENKO, J.; OLSON, S. R.; LUPU, F.; MCCARTY, O. J.; SHATZEL, J. J.The contact pathway and sepsis. Research and Practice in Thrombosis and Haemostasis, v. 3, n. 3, p. 331-339, 2019.
2. ZINGARELLI, B.; COOPERSMITH, C. M.; DRECHSLER, S.; EFRON, P.; MARSHALL, J. C.; MOLDAWER, L; WIERSINGA, W. J.; XIAO, X.; OSUCHOWSKI, M. F.; THIEMERMANN, C. Part I: Minimum Quality Threshold in Pre-clinical Sepsis Studies (mqtipss) for Study Design and Humane Modeling Endpoints. Shock (Augusta, Ga.), v. 51, n. 1, p. 10, 2019.
3. MONTEALEGRE, F.; LYONS, B. M. Fluid Therapy in Dogs and Cats With Sepsis. Frontiers in Veterinary Science, v. 8, p. 622127, 2021.
4. TILMANN, B.; WUNSCH, H. Epidemiology and outcomes. Critical Care Clinics. v. 34, n. 1, p. 15-27, 2018.
5. PRASAD V. D.; KUMAR P. R.; SREENU M. Pyometra in Bitches: A Review of Literature.Research & Reviews: Journal of Veterinary Science and Technology. 2017.
6. CHACAR, F. C. et al. Sepse em felinos. Veterinária e Zootecnia, v. 21, n. 1, p. 64-76, 2014.
7. SILVEIRA, M. M. et al. Polymerase Chain Reactionand blood culture for diagnosis of canine sepsis. Ciência Rural. v. 48, n. 6, 2018.
8. FERREIRA, M. M. T. Aplicação do método quick Sequential Organ Failure Assessment (qSOFA) em cães e gatos em estado crítico que dão entrada na urgência de um hospital veterinário. 2022. Dissertação de mestrado. Faculdade de Medicina Veterinária -Universidade de Lisboa,Lisboa.
9. SHARP, C. L. systemic inflammatory response syndrome, sepsis, and multiple organ dysfunction syndrome. In: DROBATZ, K. J.; HOPPER, K.; ROZANSKI, E.; SILVERSTEIN, D. C. (Ed.). Textbook of small animal emergency medicine. Hoboken: Wiley Blackwell, 2019. p. 1030-1037.
10. RIPANTI, D.; DINO, G.; PIOVANO, G.; FARCA, A. M. Application of the Sequential Organ Failure Assessment Score to predict outcome in critically ill dogs: Preliminary results. Schweizer Archiv Fur Tierheilkunde, v. 152, n. 8, p. 325–330, 2012.
11. BUTLER, A. L. Goal-Directed Therapy in Small Animal Critical Illness. Veterinary Clinics: Small Animal Practice, v. 41, p. 817-838, 2011.
12. ROBERTSON, C. M.; COOPERSMITH, C. M. The systemic inflammatory response syndrome. Microbes and Infection., v. 8, p. 1382-1389, 2006.
13. RIVERS, E. et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. New England Journal of Medicine., v. 345, p. 1-10, 2001.
14. MINNECI, P. C. et al. Differing effects of epinephrine, norepinephrine, and vasopressin on survival in a canine model of septic shock. American Journal of Physiology-Heart and Circulatory Physiology., v. 287, p. H2545-2554, 2004.
15. PRITTIE, J. Optimal endpoints of resuscitation and early goal-directed therapy. Journal of Veterinary Emergency and Critical Care., v. 16, p. 329-339, 2006.

Paulo Fernandes Marcusso
Formado em Medicina Veterinária pela Universidade Estadual do Norte do Paraná-UENP, Campus Luiz Meneghel, Bandeirantes, Paraná (2011), pós-graduado em Educação Lato Sensu pela Universidade Federal Fluminense-UFF, Rio de Janeiro, mestre (2014) e doutor (2015) em Patologia Animal pela Universidade Estadual Paulista “Júlio de Mesquita Filho” - UNESP, Campus Jaboticabal, Faculdade de Ciências Agrárias e Veterinárias, São Paulo. Atualmente é Professor Assistente Doutor na Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista “Júlio de Mesquita Filho” - UNESP, Campus Botucatu, nas disciplinas de Laboratório Clínico Veterinário e Práticas Interdepartamentais de Apoio ao Diagnóstico. Professor no Programa de Pós-Graduação em Medicina Veterinária da FMVZ/UNESP Botucatu atuando na linha de pesquisa de doenças inflamatórias e sepse em animais domésticos e selvagens. Tem experiência na área de Patologia Clínica Veterinária de mamíferos e não mamíferos, com ênfase em Imunopatologia, atuando principalmente nos seguintes temas: inflamação, sepse e imunoprofilaxia.

Ricardo Andres Ramirez Uscategui
Formado em Medicina Veterinária pela “Universidad de la Salle” Bogotá, Colômbia (2007). Título revalidado pela Universidade Federal de Uberlândia (2017). Mestre e Doutor em Cirurgia Veterinária pela Universidade Estadual Paulista (UNESP) Júlio de Mesquita Filho (2012 e 2016). Realizou estágio de pós-doutorado no Departamento de Medicina Veterinária Preventiva e Reprodução Animal da UNESP (2018). Foi professor do ensino superior da Universidade Federal dos Vales do Jequitinhonha e Mucuri (2018-2022). Atualmente é professor pesquisador da Faculdade de Medicina Veterinária e Zootecnia da “Universidad CES”, Medellín, Colômbia, nos níveis de graduação e pós-graduação. Atua principalmente nas áreas de: Anestesiologia, Farmacologia, Terapêutica, Emergências, Cuidados Intensivos, Sepse e Ultrassonografia de última geração.

Beatriz Gasser
Formada em Medicina Veterinária pela Universidade Estadual Paulista “Júlio de Mesquita Filho”, UNESP/Jaboticabal (2010 - 2014). Residência no Programa de Medicina Veterinária e Saúde pelo MEC/SUS, na área de Reprodução Animal e Obstetrícia Veterinária da Universidade Estadual Paulista “Júlio de Mesquita Filho”, UNESP/Jaboticabal (2015 - 2017). Mestra em Medicina Veterinária, área de Reprodução Animal pela Universidade Estadual Paulista “Júlio de Mesquita Filho”, UNESP/Jaboticabal (2017 - 2019). Doutora em Ciências Veterinárias, área de Saúde Animal pela mesma instituição (2019 - 2023), executando projetos com ênfase em sepse, ultrassonografia, anestesia e obstetrícia veterinária. Docente das disciplinas de Diagnóstico por imagem, Obstetrícia Veterinária, Clínica de Animais Selvagens, Clínica Médica de Animais de Companhia I e II no Instituto de Ciências Agrárias da Universidade Federal dos Vales do Jequitinhonha e Mucuri, Campus de Unaí, Minas Gerais.
{PAYWALL_FIM}