Por Msc Carina Freccia e MSc DipECVN Dakir Polidoro
RESUMO
FRECCIA, C. Diagnóstico presuntivo de síndrome vestibular central causada por Toxoplasma gondii em cão: relato de caso. [Presumptive diagnosis of central vestibular syndrome caused by Toxoplasma gondii. in a dog: a case report]. 2023. 54 f. Monografia (Curso de especialização em neurologia de pequenos animais) – Anclivepa- SP, São Paulo, 2023.
Este trabalho tem como objetivo relatar um caso de síndrome vestibular central presuntivamente causada por Toxoplasma gondii em um cão, descrever os achados do exame neurológico, resultados dos exames complementares e relatar o tratamento empregado e a evolução clínica do paciente. Foi apresentado um cão, fêmea, sem raça definida, com sinais clínicos iniciais de incoordenação e rolamentos. De acordo com o proprietário, o cão convivia diariamente com felinos e apresentava frequentemente coprofagia. Ao exame neurológico, o animal apresentava inclinação de cabeça à direita, ataxia vestibular, nistagmo espontâneo conjugado, que muda de posição para horizontal e vertical com fase rápida à esquerda e estrabismo espontâneo ventromedial do olho direito. Com base no exame neurológico, a lesão foi localizada no tronco encefálico do lado direito. Foram feitas radiografia, fibrovideotoscopia e colheita de líquido cefalorraquidiano (LCR). Foi realizado PCR do LCR para cinomose, toxoplasmose e neosporose, o qual foi positivo para toxoplasmose. O cão foi submetido ao tratamento com clindamicina (10 mg/kg, BID) por 28 dias. Após esse período, o animal se apresentava neurologicamente normal. A toxoplasmose canina pode estar associada a ingestão de alimentos crus ou mal higienizados ou a coprofagia de fezes felinas. Infecção por Toxoplasma gondii deve ser considerado um diferencial em cães com hábitos de coprofagia e que apresentem sinais neurológicos centrais, incluindo síndrome vestibular. O PCR do LCR reforça a suspeita clínica e o tratamento com clindamicina auxiliou no tratamento do presente relato, onde o diagnóstico presuntivo de toxoplasmose foi realizado. A literatura traz pouco sobre casos de toxoplasmose em SNC de cães com síndrome vestibular causada por Toxoplasma gondii.
Palavras-chave: protozoário, cão, vestibulopatia, líquido cefalorraquidiano.
{PAYWALL_INICIO}
INTRODUÇÃO
A síndrome vestibular canina é uma manifestação comumente encontrada na prática clínica veterinária (HARRISON et al. 2021). Inclinação de cabeça, ataxia, nistagmo patológico e estrabismo posicional são sinais clínicos clássicos comuns em cães com disfunção vestibular. (COELHO; GUTIERREZ; MARTINS, 2013; HARRISON et al., 2021). Embora estes sinais clínicos facilitem no reconhecimento da disfunção do sistema vestibular, eles raramente auxiliam na determinação da causa da doença (MUÑANA, 2013).
Doenças infecciosas e inflamatórias são possíveis diagnósticos em casos de síndrome vestibular central, podendo ter origem viral (vírus da imunodeficiência felina, vírus da leucemia felina, raiva, peritonite infecciosa felina), coccidiosa (toxoplasmose e neosporose), fúngica (criptococose) ou bacteriana (PLATT; OLBY, 2014). Toxoplasma gondii é um protozoário coccicídeo gerador de parasitoses em diversos animais e seres humanos (WEESE; EVASON, 2020). Sua forma oocística infectante é encontrada nas fezes de felinos, o qual é seu hospedeiro definitivo (MONTEIRO, 2017). Mesmo assim, a ingestão de carne de animais parasitados não devidamente cozida é a forma mais comum de infecção (BOWMAN, 2020). Geralmente, nos animais, a infecção por T. gondii causa sinais clínicos como anorexia, letargia, febre, distrição respiratória e disfunções neurológicas, como crises epilépticas, déficits em nervos cranianos, ataxia, paresia, paralisia e miosite (WEESE; EVASON, 2020).
A toxoplasmose em cães e gatos está associada a sinais neurológicos principalmente em casos de meningoencefalite (PLATT; OLBY, 2014), que geralmente estão relacionados à proliferação dos taquizoítos, um dos estágios de vida do T. gondii (WEESE; EVASON, 2020). O diagnóstico pode ser feito com base nos sinais clínicos, testes sorológicos, análise e PCR do LCR e ressonância magnética (RM) do encéfalo (DEWEY; DA COSTA, 2016). Em gatos, também é possível encontrar oocistos por meio de exame coproparasitológico (ZAJAC et al., 2021).
O uso da clindamicina é o tratamento de primeira escolha para toxoplasmose. Sulfonamidas associadas a trimetropima ou pirimetamina também podem ser utilizadas, com terapia de aproximadamente 2 a 4 semanas (DEWEY; DA COSTA, 2016). Embora raro, a infecção por T. gondii através do contato com felinos pode ser prevenida evitando o contato direto com fezes contendo oocistos, limpando-se a caixa de areia diariamente, utilizando-se luvas no manuseio do material e após a limpeza ou manejo de áreas comuns, como jardins ou solo os quais felinos infectados também tem acesso (ETTINGER; FELDMAN; CÔTÉ, 2017).
REVISÃO DE LITERATURA
SÍNDROME VESTIBULAR CENTRAL
O sistema vestibular é responsável por manter a posição dos olhos, pescoço, tronco e membros em relação à posição ou movimento da cabeça (DE LAHUNTA; GLASS; KENT, 2021). Também está intimamente conectado com os músculos extraoculares responsáveis pelos movimentos oculares reflexos e pelo rastreamento de objetos no espaço (DEWEY; DA COSTA, 2016).
Ele consiste em estruturas proprioceptoras especiais dentro do osso petroso temporal (ouvido interno), o nervo vestibular e quatro núcleos do tronco cerebral localizados na medula oblonga rostral em cada lado do quarto ventrículo (PLATT; OLBY, 2014). O labirinto ósseo existente na região petrosa do osso temporal e três porções contínuas repletas de líquido (Figura 1), sendo o grande vestíbulo. Os três canais semicirculares e a cóclea; a dilatação em cada um dos canais semicirculares são a ampola. Todos estes três componentes são preenchidos pela perilinfa, fluido semelhante ao LCR, podendo ser oriundo dele. (DE LAHUNTA; GLASS; KENT, 2021).
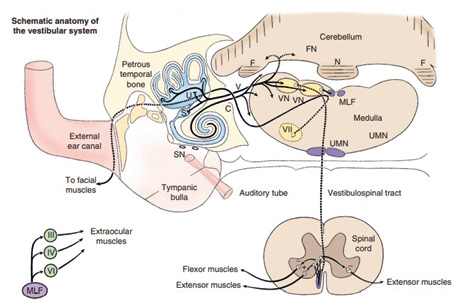
Esse sistema pode ser dividido em sistema vestibular periférico e sistema vestibular central (BOUDREAU et al., 2018; DYCE; SACK; WENSING, 2019). As vias periféricas são um conjunto de estruturas localizadas no ouvido médio e ouvido interno; já as vias centrais estão localizadas principalmente no tronco encefálico e no cerebelo (DE LAHUNTA; GLASS; KENT, 2021).
O aparelho vestibular é revestido por células ciliadas que fazem sinapses sobre os neurônios motores com axônios pertencentes ao nervo vestibulococlear, onde conduzem potenciais de ação para a medula espinhal (DYCE; SACK; WENSING, 2019).
A porção vestibular do nervo vestibulococlear faz sinapses com os núcleos vestibulares localizados na medula oblonga e com os neurônios da região rostral do cerebelo. Os núcleos vestibulares são conectados através do fascículo longitudinal medial até os núcleos dos nervos cranianos oculomotor, troclear e abducente para controlar os movimentos dos olhos. Este sistema ajuda a manter a conjugação do olhar quando a cabeça se move. Os núcleos vestibulares também estão conectados às vias descendentes para os neurônios na medula espinhal que fornecem tônus nos músculos do pescoço, tronco e dos músculos antigravitacionais dos membros (THOMAS et al., 2000).
Desordens no aparelho vestibular podem cursar sinais clínicos relacionados ao posicionamento do bulbo ocular, como a presença de nistagmo patológico (vertical, horizontal ou rotatório) ou estrabismo posicional. Outros sinais vistos são ataxia vestibular, andar de base ampla, rolamentos, andar em círculos e quedas (PLATT; OLBY, 2014).
As doenças vestibulares são comuns em cães e podem resultar de uma lesão em um dos componentes vestibulares periféricos ou central e os sinais clínicos são representados pela inclinação da cabeça, cair, inclinar-se, rolar, circular, nistagmo, estrabismo e ataxia, isoladamente ou combinados (STANCIU et al., 2016). Alguns sinais clínicos podem auxiliar na diferenciação entre sistema vestibular central (cerebelo ou tronco encefálico) ou periférico (ouvido interno ou nervo vestibular) (Quadro 1) (PLATT; OLBY, 2014).
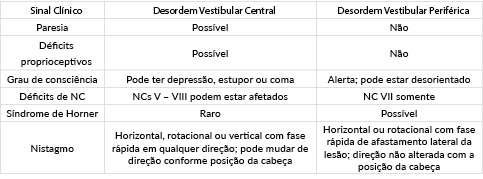
Fonte: Adaptado de Platt e Olby (2014).
Sinais vestibulares também podem ser vistos em lesões cerebelares que envolvem o lobo floculonodular o núcleo fastigial do cerebelo e o pedúnculo cerebelar caudal. Neste caso, a síndrome vestibular é denominada de paradoxal, pois a inclinação da cabeça e o movimento circular ocorrem contralaterais à lesão (PLATT; OLBY, 2014). Quando o envolvimento da lesão vestibular for bilateral, o sinal mais comum é a ataxia vestibular simétrica com rápido balançar da cabeça de um lado para o outro, sem a presença de nistagmo patológico (LORENZ; COATES; KENT, 2011). Sinais vestibulares associados à perda de visão, crises epilépticas e comportamento anormal podem indicar lesão em prosencéfalo também (DEWEY; DA COSTA, 2016).
O exame neurológico é um teste não invasivo e barato, que é essencial para escolher a investigação diagnóstica apropriada para detectar a etiologia da disfunção vestibular (BONGARTZ et al., 2019). Diagnósticos de doenças vestibulares direcionam a síndrome vestibular entre estruturas central ou periférica e determinam a busca ou não de imagens avançadas e o tipo de imagem a ser solicitada (BOUDREAU et al., 2018).
As radiografias de cabeça podem ser benéficas na avaliação de animal com suspeita de traumatismo de crânio, porém não fornecem maiores informações em doença vestibular central (DEWEY; DA COSTA, 2016). Vários exames diagnósticos como otoscopia, radiografia de crânio, tomografia computadorizada, miringotomia e análise de líquor podem levar a resultados inespecíficos ou insuficientes (GAROSI et al., 2001).
A tomografia computadorizada pode ser ferramenta mais eficiente para avaliar tecido ósseo, no entanto, o exame de ressonância magnética permitirá melhor avaliação do osso e superior em tecidos moles (DEWEY; DA COSTA, 2016). A sensibilidade e especificidade da ressonância magnética foi evidenciada em estudo recente (BOUDREAU et al., 2018). Além disso, não existem testes clínicos que estabeleçam a presença de disfunção vestibular, e quando associado a disfunção de componentes centrais muitas vezes é primordial diagnósticos mais onerosos.
Toxoplasmose
Toxoplasma gondii é um protozoário entérico, do Filo Apicomplexa, Classe Conoidasida, Família Sarcocystidae, que parasita mamíferos (incluindo seres humanos) e aves, mas tem como seu hospedeiro definitivo o gato (TAYLOR; COOP; WALL, 2017; WEEZE; EVASON, 2020). É um parasita intracelular obrigatório que possui três estágios infecciosos: esporozoítos (presentes nos oocistos, eliminados nas fezes de felinos infectados), taquizoítos (forma de replicação rápida) e bradizoítos (forma de replicação lenta) em cistos teciduais (DUBEY, 2021). Existem relatos de outros felídeos e carnívoros como hospedeiros definitivos (hospedeiros que possibilitam a formação de micro e macrogametas), porém, somente os felinos expulsam oocistos através das fezes para o ambiente (BOWMAN, 2020).
O T. gondii é encontrado em todas as regiões do mundo, mais comumente em zonas quentes e tropicais, com menor prevalência em áreas secas e frias (WEEZE; EVASON, 2020). Os oocistos, quando esporulados, são dispóricos (com dois esporocistos); os esporocistos são tetrazóicos (com quatro esporozoítos), possuem formato esférico (Figura 2) e medem aproximadamente 10 µm, e nessa fase se tornam infectantes pelo processo apical dos esporozoítos (MONTEIRO, 2017).
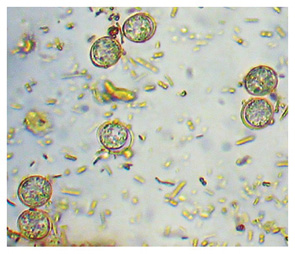
Fonte: Monteiro, 2017.
O ciclo de vida deste protozoário é do tipo heteróxeno facultativo, alterna entre os estágios sexual e assexual, que ocorre no hospedeiro definitivo e intermediário, respectivamente (DUBEY, 2021). A infecção, em gatos, começa com a ingestão de bradizoítos de caças contaminadas (normalmente roedores) (Figura 3) ou pedaços de carne com cistos; a ingestão de oocistos presentes no ambiente é menos comum (WEEZE; EVASON, 2020). Em suma maioria, as infecções (tanto em hospedeiros definitivos, quanto intermediários) são brandas ou assintomáticas (TAYLOR; COOP; WALL, 2017).
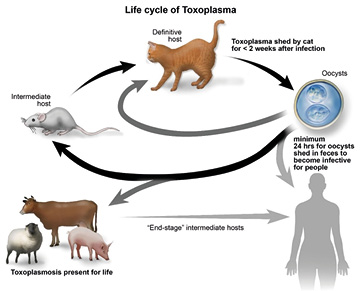
Fonte: Google 2023; adaptado de https://www.vet.cornell.edu.
Após a ingestão, os cistos se liberam de sua parede celular no estômago, e, quando atingem o epitélio intestinal, há a evolução dos bradizoítos por merogonia (divisão da célula após replicação celular; reprodução assexuada), formando os merozítos; e a gametogonia (reprodução sexuada), formando novos
oocistos em um período de 3 a 10 dias (WEEZE; EVASON, 2020). Estes serão eliminados durante 1 a 2 semanas (TAYLOR; COOP; WALL, 2017). Essa fase sexuada só ocorre em gatos por conta de um detalhe notável: os felinos não possuem a enzima delta-6-dessaturase, responsável pela metabolização do ácido linoleico; sendo assim, há uma sobra dessa substância, que acaba suplementando as células epiteliais intestinais, gerando o ambiente propício para a reprodução (DUBEY, 2021).
A forma assexuada pode ocorrer em hospedeiros definitivos e intermediários, onde, a partir dos esporozoítos que penetraram a parede intestinal, há a formação de bradizoítos em tecidos do corpo (WEEZE; EVASON, 2020). Os taquizoítos, originados de esporozoítos ingeridos, podem infectar vários tecidos e transformar-se em bradizoítos (WEEZE; EVASON, 2020).
Os bradizoítos podem estar presentes em tecidos como cérebro, musculatura estriada e fígado, e, ainda, se manterem viáveis durante a vida do hospedeiro (BOWMAN, 2020). Nessa fase, criam uma parede cística como proteção contra anticorpos, motivo por conseguirem se manter assim por tanto tempo (MONTEIRO, 2017). Os oocistos eliminados nas fezes esporulam entre 1 e 5 dias após a evacuação, contendo então esporozoítos infectantes que podem sobreviver por meses no ambiente (WEEZE; EVASON, 2020).
Apesar de raro, animais infectados for T. gondii podem desenvolver meningoencefalite. Em cães com suspeita de meningoencefalite, 4% possuíram histórico de exposição ao T. gondii, mas apenas 0,25% dos casos apresentaram infecção ativa (COELHO et al., 2019). Um estudo histológico em 100 gatos infectados por T. gondii revelou que 80% deles possuíam lesões no SNC (WEEZE; EVASON, 2020).
A clindamicina na dose de 10 mg/kg, BID, durante 4 semanas, é o tratamento mais indicado na literatura (WEEZE; EVASON, 2020). A combinação de sulfonamida e trimetropima (15 mg/kg, VO, BID) também é descrita como eficiente, assim como a pirimetamina com sulfonamida (0,5 mg/kg, VO, BID), ambos durante 4 semanas (NELSON; COUTO, 2015; WEEZE; EVASON, 2020).
O prognóstico geralmente é favorável, com resolução do quadro em poucos dias; com exceção dos quadros neurológicos, pulmonares e hepáticos, onde o prognóstico é mais reservado (WEEZE; EVASON, 2020). Gatos infectados serão considerados sempre soropositivos, sendo a recidiva dos sinais clínicos possíveis (NELSON; COUTO, 2015). É indicado que os gatos não tenham acesso à rua para não ingerirem possíveis caças contaminadas com o parasita, assim como não alimentar quaisquer animais com carne malcozida ou crua (WEEZE; EVASON, 2020).
Na análise do LCR, a contagem de células nucleadas e a concentração de proteínas estão frequentemente elevadas, com pleocitose geralmente mista ou eosinofílica (PLATT; OLBY, 2014; NELSON; COUTO, 2015). Em suspeitas neurológicas, exames de imagem da região craniana, de preferência ressonância magnética, devem ser feitos para evidenciar lesões como granulomas (DEWEY; DA COSTA, 2016).
Em cortes histológicos, podem ser vistos pseudocistos e cistos do parasita, mas testes sorológicos também auxiliam no diagnóstico da infecção e se está na fase aguda (IgM) ou crônica (IgG) (MONTEIRO, 2017). Os materiais utilizados para esses testes podem incluir soro sanguíneo, fluido ocular e LCR (LORENZ; COATES; KENT, 2011).
A toxoplasmose generalizada está mais comumente associada a cães imunossuprimidos com o vírus da cinomose (ZAJAC et al., 2021). Em cães idosos, o sistema neuromuscular é mais predominantemente acometido, gerando quadros de crises epilépticas, déficits em nervos cranianos, ataxia, paresia, paralisia e miosite, o que muitas vezes leva a infecção a ser confundida com quadros causados por Neospora caninum (WEEZE; EVASON, 2020). Em cães com menos de 1 ano de idade os sinais mais comuns são de diarreia, vômito e febre; pneumonia e icterícia por hepatopatia podem ocorrer também (WEEZE; EVASON, 2020).
RELATO DE CASO
Foi atendido um cão, fêmea, esterilizada, 10 anos de idade, sem raça definida (SRD), pesando 7,6 kg (Figura 4). De acordo com o proprietário, dois dias antes da consulta, o animal apresentou inclinação de cabeça, incoordenação e nistagmo. A paciente não era imunizada, havia sido desverminada há dois meses e convivia com oito cães e cinco gatos. Possuía histórico de otite e que fora tratada com metronidazol e espiramicina , solução auricular à base de diazinon, pimaricina, neomicina e acetato de dexametasona e prednisolona, apresentando melhora do quadro clínico. O proprietário também relatou presença de secreção auricular no dia da consulta, com maior intensidade e coloração mais escura no ouvido esquerdo há dois dias, e que realizou limpeza auricular da paciente. Apresentava cardiopatia de acordo com a tutora, embora a mesma não tenha apresentado o exame específico. Foi tratada por três meses com cloridrato de benazepril, porém tutora não observou evolução do quadro e suspendeu o tratamento. De acordo com o proprietário, o animal também apresenta hábito de coprofagia. Não possuía histórico de trauma.
Fonte: Arquivo pessoal (2022).
No exame físico, o animal apresentou frequência cardíaca 96 batimentos por minuto, frequência respiratória 44 movimentos por minuto, temperatura retal 38,4ºC, mucosas róseas, desidratação 6%, tempo de preenchimento capilar de 2 segundos, sem dor à palpação abdominal. No exame neurológico, o cão estava alerta e responsivo, apresentava pleurotótono e inclinação de cabeça para direita e tetraparesia não deambulatória. Na avaliação dos nervos cranianos, apresentava reação à ameaça presente bilateral, reflexo pupilar fotomotor (direto e consensual) presentes bilateralmente, reflexo oculocefálico presente, estrabismo ventromedial no olho direito, nistagmo espontâneo conjugado com fase rápida para esquerda, reflexo palpebral presente bilateral, sensibilidade nasal presente bilateral, simetria de face e de língua. Não foram observados tremores de intenção. Apresentava muitos rolamentos à direita durante a avaliação o que dificultou realização das reações posturais. Na avaliação dos reflexos espinhais segmentares, os reflexos patelares e reflexos de retirada estavam presentes. Sem dor a palpação epaxial.
Com base no exame neurológico, sugere-se localização de lesão em tronco encefálico do lado direito e em região tálamo-cortical, indicando síndrome vestibular central. Diagnósticos diferenciais incluíram; doenças infecciosas, inflamatórias ou neoplásicas. Exames de sangue, incluindo hemograma (exame automatizado) e bioquímicos (ureia, creatinina, ALT, FA, glicose), permaneceram dentro dos valores de referência, exceto moderada leucocitose (23.900/mm3) e a FA levemente elevada (251 U/L). Foi realizada radiografia de crânio para observação das bulas timpânicas, as quais apresentaram sinais sugestivos de otite externa (Figura 5).
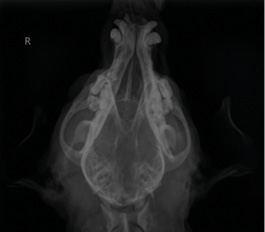
Terapia foi iniciada com fluidoterapia (Ringer-lactato na taxa de 2,5 ml/kg/hora), citrato de maropitant (1 mg/kg/SID IV), cloridrato de ondansetrona (0,5 mg/kg/BID IV). Durante a internação, o animal apresentou piora do quadro clínico, os rolamentos se tornaram mais severos e, por conta disso, optou-se pela realização de infusão sedoanalgesia de cloridrato de remifentanila (10 mcg/kg/hora), cloridrato de cetamina (0,6 mg/kg/hora) e cloridrato de dexmedetomidina (1 mcg/kg/hora), por 20 horas.
Foi indicado ao tutor a coleta e análise do LCR, fibrovideotoscopia e ressonância magnética de crânio. Devido aos custos, o tutor optou por não realizar a ressonância magnética. Para a colheita de LCR e fibrovedeotoscopia, (anexo A) realizadas no dia seguinte à consulta, realizou-se medicação pré-anestésica dexmedetomidina 4 mcg/kg, cetamina 1 mg/kg e cloridrato de metadona 0,2 mg/kg, por via intramuscular. A indução anestésica foi realizada com propofol 2 mg/kg, por via intravenosa. Após atingir o plano anestésico adequado, o paciente foi intubado com sonda endotraqueal n° 6 e acoplado ao circuito anestésico valvular com O2 diluído a 100% e infusão de propofol 2 mg/kg/min e remifentanil 10 mcg/kg/min em taxa variável para manutenção da anestesia.
Após colheita, o LCR foi encaminhado para análise citológica o qual ocorreu após algumas horas por se tratar de análise em laboratório externo. Foi também realizado PCR do LCR para cinomose, neospora e toxoplasmose. Colheu-se também material otológico para análise citológica, evidenciando a presença de Malassezia sp. em ambos os condutos auditivos. Para o conduto auditivo esquerdo foi recomendado o uso de gentamicina, cetoconazol e valerato de betametasona, BID, por 10 dias, e no conduto auditivo direito (com mais secreção), foi realizada miringotomia e drenagem de secreção. Orientou-se de formulação manipulada de ciprofloxacina 0,5 %, miconazol 1 %, dexametasona 0,1 % Tris EDTA qsp (frasco 30 ml/ 1 ml/ BID/ 15 dias). Foi recomendado o uso de colírio a base de ciprofloxacino e dexametasona, 10 gotas, BID até que a formulação indicada ficasse pronta.
Após o tratamento otológico, foi realizada a manutenção com clorexidina 0,15%, miconazol 1% e furoato de mometasona 0,1 %, tris EDTA qsp (frasco 30 ml/1 ml em cada ouvido, SID, 1 vez por semana) e solução de limpeza com ácido salicílico e ácido lático, para evitar a recidiva de Malassezia sp. Foram também adicionados ao tratamento; prednisolona na dose de 1,3 mg/kg, SID, 4 dias, por via oral, sulfadoxina-trimetoprim, na dose de 15 mg/kg,
SID, 4 dias, por via intravenosa e cloridrato de meclizina na dose de 12,5 mg por animal, SID, por via oral.
No segundo dia de internamento (Figura 6), recebendo as medicações prescritas, e alimentação na seringa, sem perda de apetite. Ainda necessitou de infusão sedoanalgesia, por conta de rolamentos. No terceiro dia não apresentou rolamentos e foi realizado o desmame total da infusão. No quarto dia obteve melhora do quadro, sem rolamentos, moderada ataxia vestibular e capacidade de se manter em estação. No quinto dia apresentava-se clinicamente estável, deambulando com discreta lateralização de cabeça à direita. Neste dia os resultados de PCR do LCR de cinomose, neospora e toxoplasmose foram obtidos, constatando toxoplasmose positivo, alterando a conduta terapêutica suspendendo a prednisolona.

Fonte: Arquivo pessoal (2022).
No quinto dia recebeu alta com acompanhamento e manutenção da prescrição otológica anteriormente citada. Foi prescrito prednisolona 1,3 mg/kg/SID (4 dias), após 0,6 mg/kg/SID (4 dias), e em mesma dose em dias alternados mais 4 dias. Foi prescrito também cloridrato de meclizina na dose de 12,5 mg/animal/SID/15 dias e cloridrato de clindamicina, na dose de 10 mg/kg/ BID/ 28 dias.
Foi indicado manejo ambiental, limpeza de potes e camas, e observação dos demais pacientes. Já no dia quinquagésimo quinto, a paciente foi novamente atendida, apresentou melhora do quadro clínico, discreta lateralização da cabeça à direita. Seguiu apenas tratamento com cloridrato de clindamicina. Neste dia foi realizado coleta de sangue para hemograma, fosfatase alcalina e sorologia de toxoplasmose. Apresentou aumento de apenas de FA (906 U/L). O PCR para toxoplasma da amostra sanguínea apresentou-se negativa e o tratamento foi descontinuado após o resultado negativo de toxoplasmose.
DISCUSSÃO
Com base no histórico, anamnese, localização neuro-anatômica e resultados dos exames complementares, foi feito diagnóstico presuntivo de síndrome vestibular central em decorrência de uma infecção por T gondii. Uma das grandes limitações desse relato de caso foi a ausência de um estudo de imagem avançado, como a ressonância magnética, que poderia reforçar o diagnóstico presuntivo no caso de uma lesão em tronco encefálico do lado direito. A obtenção de diagnósticos de desordens que causem a síndrome vestibular central requer diagnósticos mais onerosos que desordens que afetem componentes vestibulares periféricos (HARRISON et al. 2021). A obtenção de sinais clínicos, histórico clínico e achados do exame neurológico, podem ser usados para gerar uma lista de diagnósticos diferenciais em cães com síndrome vestibular (HARRISON et al. 2021).
Segundo De Lahunta, Glass e Kent (2021), acreditava-se que o nistagmo vertical somente era visto em doenças que acometessem o sistema vestibular central, mas agora, acredita-se que essa ideia pode ser incorreta e muito superficial. Alguns pacientes acometidos por síndrome vestibular periférica podem apresentar nistagmo vertical, com um componente rotatório. Por conta disso, nistagmo vertical somente, não deve ser usado como sinal clínico para distinguir síndrome vestibular periférica de central. Já a presença de um nistagmo com a fase rápida em direção ao lado lesão ou o nistagmo que muda de direção quando se muda a posição da cabeça, são os únicos sinais confiáveis de um nistagmo patológico que indicaria uma lesão no sistema vestibular central.
Paresia de membros na doença vestibular central é causada por lesão das vias do neurônio motor superior que se projetam através do tronco encefálico (DE LAHUNTA; GLASS; KENT, 2021). Por definição, tetraparesia não ambulatória não ocorre em cães com doença vestibular periférica, já que as vias motoras voluntárias não fazem parte do sistema vestibular periférico (CHAVES, et al. 2014). No caso em questão frente aos achados do exame neurológico e suspeita de síndrome vestibular central os exames complementares puderam ser elencados, sendo assim foram realizados prioritariamente colheita de LCR para solicitação de painel neurológico de principais doenças infecciosas. A fibrovideotoscopia foi realizada para descarte de causa vestibular periférica concomitante, histórico pregresso de otite e secreção aparente no presente caso.
Apesar de o presente trabalho ser da espécie canina, Mattei et al. (2016), reportou em felinos ao analisar 15 gatos soropositivos para T. gondii e com sinais neurológicos foi observado que 40% apresentaram sinais vestibulares com cabeça inclinada, andar em círculos pendendo para o lado da lesão e tremor de cabeça, mostrando que os sinais clínicos variam muito conforme a espécie, idade, raça; no presente caso foi observado sinais vestibulares com cabeça inclinada, rolamentos e quedas à direita, sendo compatível com a observação do presente trabalho. Os sinais clínicos descritos acima são compatíveis com síndrome vestibular central, que comumente cursam com cabeça inclinada, pleurotótono, quedas e rolamentos, estrabismo e, principalmente, nistagmo horizontal e vertical (DEWEY; DA COSTA, 2016).
Com base no histórico e anamnese, suspeitou-se de síndrome vestibular central de origem infecciosa, inflamatória ou neoplásica; a convivência com cinco felinos no mesmo ambiente se fez importante, visto que uma das formas de infecção é a ingestão de oocistos presentes nas fezes de felinos, mas a informação a respeito do manejo ambiental do caso não foi clara. Segundo Nelson e Couto (2015), e Bresciani et al. (2016) a infecção pode ser evitada, com o controle da coprofagia e cozimento da carne e seus subprodutos. Concordando com presente caso, Borges-Silva et al. (2021) também constataram a presença de T. gondii por detecção em LCR, porém estes realizaram adicionalmente análise de polimorfismo de comprimento de fragmentos de DNA (RFLP) para isolamento e caracterização genética, e posterior inoculação em ratos para verificar a sua virulência.
Achados anormais no LCR sempre indicam uma anormalidade patológica se a contaminação sanguínea tiver sido descartada (Terlizzi e Platt 2009). No entanto, LCR normal também foi identificado em cães com achados clínicos e de imagem anormais, à semelhança de relatos anteriores em cães com diferentes tipos de encefalites (Tipold 1995, Cherubini et al. 2006, Granger et al. 2010).
Segundo Danciu et al. (2021), a análise do LCR pode não ser confiável para diferenciar síndrome vestibular central ou periférica. O LCR contém muito pouca proteína; isso faz com que os leucócitos presentes se deteriorem rapidamente. Idealmente, as amostras de LCR devem ser analisadas ou preservadas o mais rápido possível após a colheita, preferencialmente dentro de 1 hora, para minimizar a degradação celular. (PLATT; OLBY, 2014). No caso relatado, por questão logística, a amostra foi processada em mais de uma hora. Portanto, a análise citológica normal da amostra pode ter sido em decorrência da demora na análise e não por não haver alteração no encéfalo.
No entanto, esta técnica de diagnóstico pode revelar informações clinicamente úteis em cães com causas específicas de síndrome vestibular. A decisão de obter o LCR e sua posterior análise deve, portanto, ser considerado e interpretado através do histórico clínico, achados do exame e resultados de outros diagnósticos testes, corroborando com o raciocínio clínico do presente trabalho.
O estudo realizado por Mattei et al. (2016) mostraram que 15 gatos tratados com clindamicina, 14 tiveram remissão dos sinais clínicos em até 28 dias. O tratamento com clindamicina (10 mg/kg, BID, por 28 dias) é o de eleição, podendo apresentar remissão dos sinais clínicos em até 48 horas. Porém, quando há acometimento neurológico, o tempo de remissão pode ser maior (WEEZE; EVASON, 2020). As alterações vistas em exames de sangue são correlacionadas com a literatura, visto que é esperada a presença de leucocitose e aumento dos níveis de enzimas hepáticas (WEEZE; EVASON, 2020).
O uso de ondansetrona (0,5 mg/Kg) auxiliou no controle de náuseas e vômitos do presente caso corroborando com HENZE et al. (2022). Sobre a forma de contágio, acredita-se que ela, por ter gatos como contactantes, possa ter tido hábitos coprofágicos e adquirido a toxoplasmose pela ingestão de fezes felinas. Uma nova pesquisa pelo parasita em soro sanguíneo por PCR foi feita 55 dias após o diagnóstico, gerando resultado negativo. A orientação sobre evitar a possibilidade dessa ingestão foi passada, e a paciente seguiu com remissão do quadro clínico.
CONSIDERAÇÕES FINAIS
O caso descrito teve evolução similar conforme a literatura, a forma de diagnóstico foi extremamente importante para a escolha do tratamento, oferecendo resultados satisfatórios. Quando se trata de lesões neurológicas, o exame físico criterioso é a porta de entrada para o encaminhamento diagnóstico. Nele, é possível ter-se uma noção da origem e localização de uma lesão, facilitando os próximos passos e visando o bem-estar do paciente;
O tratamento proposto foi o de eleição citado pela literatura e teve resultado positivo, trazendo resolução do quadro clínico em curto espaço de tempo. A literatura traz pouco sobre casos de toxoplasmose em SNC de cães. Ainda menos sobre síndrome vestibular causada por este parasita.
A maioria dos casos com desfecho terapêutico é acerca de felinos, e, mesmo assim, acaba não sendo muito imersivo. Muitos diagnósticos acabam sendo post-mortem.
REFERÊNCIAS BIBLIOGRÁFICAS
BONGARTZ, U. et al. Vestibular disease in dogs: association between neurological examination, mri lesion localisation and outcome. Journal Of Small Animal Practice. Hannover, v. 61, n. 1, p. 57-63, 13 set. 2019. Wiley. http://dx.doi.org/10.1111/jsap.13070.
BORGES-SILVA, Waléria et al. Cytologic detection of Toxoplasma gondii in the cerebrospinal fluid of a dog and in vitro isolation of a unique mouse-virulent recombinant strain. Journal of Veterinary Diagnostic Investigation. [S.L.], v. 33, n. 3, p. 591–594, 2021. https://doi.org/10.1177/1040638721996685
BOUDREAU, C et al. Reliability of interpretation of neurologic examination findings for the localization of vestibular dysfunction in dogs. Journal of the American Veterinary Medical Association. [S.L.] , v. 252, n. 8, p. 830–838, 2018.
BOWMAN, Dwight. Georgi’s Parasitology for Veterinarians. 11ª ed., New York:
Elsevier, 2019.
BRESCIANI, K. D. S. et al. Epidemiological aspects of feline toxoplasmosis. Archives of Veterinary Science. [S.L.], v. 21, n. 2, p. 01-08, 2016.
CHAVES, Rafael O. et al. Doença vestibular em cães: 81 casos (2006-2013). Pesquisa Veterinária Brasileira, [S.L.], v. 34, n. 12, p. 1210-1214, dez. 2014. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s0100-736×2014001200015.
CHERUBINI GB, Platt SR, Anderson TJ. Characteristics of magnetic resonance images of granulomatous meningoencephalomyelitis in 11 dogs. Veterinary Record. 2006;159(4):110–5.
COELHO, A. M. et al. Serological prevalenceof toxoplasmosis and neosporosis in dogs diagnosed with suspectedmeningoencephalitis in the UK. J Small Anim Pract. [S.I], v. 60, p. 44-50, 2019.
COELHO, M.P.R.C.; GUTIERREZ, J.S.; MARTINS, B. DE C. Neurologia em Cães e Gatos. Cadernos Técnicos de Veterinária e Zootecnia, v. 69, p. 9–10, 2013.
DANCIU, Cecilia Gabriella et al. Cerebrospinal fluid analysis lacks diagnostic specificity in dogs with vestibular disease. Veterinary Record, [S.L.], v. 189, n. 10, p. 1-8, 7 jun. 2021. Wiley. http://dx.doi.org/10.1002/vetr.557.
DE LAHUNTA, Alexander; GLASS, Eric; KENT, Marc. Veterinary Neuroanatomy and Clinical Neurology. 5. ed., St. Louis:
Saunders Elsevier, 2021.
DEWEY, Curtis W.; DA COSTA, Ronaldo Casemiro. Practical Guide to Canine and Feline Neurology. 3.ed. St Louis: Saunders Elselvier, 2016. 3.ed. 2016.
DUBEY, J. P. Toxoplasmosis of Animals and Humans. 3ªed., FL: Taylor & Francis Group, 2022.
DYCE, Keith M.; SACK, W. O.; WENSING, J. G. Tratado de Anatomia Veterinária. 5ª ed. São Paulo: GEN Guanabara Koogan, 2019.
ETTINGER, Stephen J., FELDMAN, Edward C., COTTÉ, Etienne. Textbook of Veterinary Internal Medicine. 8ª ed., Missouri: Elsevier, 2017.
GAROSI, Laurent. S., DENNIS, Ruth, PENDERIS, Jacques., et al. Results of magnetic resonance imaging in dogs with vestibular disorders: 85 cases (1996-1999). Journal of the American Veterinary Medical Association. 218, 385-391, 2001.
GRANGER N, Smith PM, Jeffery ND. Clinical findings and treatment of non-infectious meningoencephalomyelitis in dogs: a systematic review of 457 published cases from 1962 to 2008. Veterinary Journal. 184(3):290–7, 2010.
HARRISON, Eleanor et al. Clinical reasoning in canine vestibular syndrome: which presenting factors are important?. Veterinary Record, Hatfield, v. 188, n. 6, p. 1-10, 19 fev. 2021. Wiley. http://dx.doi.org/10.1002/vetr.61
HENZE, Lea et al. Ondansetron in dogs with nausea associated with vestibular disease: A double-blinded, randomized placebo-controlled crossover study. Journal Of Veterinary Internal Medicine. Hannover, v. 36, n. 5, p. 1726-1732, 29 jul. 2022. Wiley. http://dx.doi.org/10.1111/jvim.16504.
LORENZ, Michael D.; COATES, Joan R.; KENT, Marc. Handbook of Veterinary Neurology. 5ª ed. St Louis: Elselvier, 2011.
MATTEI, E. et al. A clinical e serological follow-up on cats with neurological disorders suspected for toxoplasmosis. Rev Rom Med Vet. v. 26, n. 4, p. 37 – 40, 2016.
MONTEIRO, Silvia Gonzalez. Parasitologia na Medicina Veterinária. 2ª ed., Rio de Janeiro: Roca, 2017.
MUÑANA, Karen R.. Update: seizure management in small animal practice. Veterinary Clinics Of North America: Small Animal Practice, [S.L.], v. 43, n. 5, p. 1127-1147, set. 2013. Elsevier BV. http://dx.doi.org/10.1016/j.cvsm.2013.04.008.
NELSON, Richard W; COUTO, Guilhermo C. Medicina Interna de Pequenos Animais. 5ª ed., Rio de Janeiro: Elsevier, 2015.
PLATT, Simon R.; OLBY, Natasha J. BSVA of Manual of Canine and Feline Neurology.
4ª ed. Inglaterra: BSAVA, 2014. 552p.
STANCIU, G. D. et al. Evaluation of central vestibular syndrome in dogs using brainstem auditory evoked responses recorded with surface electrodes. Arq. Bras. Med. Vet. Zootec. Iasi, v.68, n.6, p.1422-1430, 2016. http://dx8820.doi.org/10.1590/1678-4162-.
TAYLOR, M. A.; COOP, R.L.; WALL, R.L. Parasitologia Veterinária. 4ª ed., Rio de Janeiro: Guanabara Koogan, 2017.
TERLIZZI E PLATT. The function, composition and analysis of cerebrospinal fluid in companion animals: Part II – Analysis.The Veterinary Journal 180 (2009) 15–32.
TIPOLD A. Diagnosis of inflammatory and infectious disease of the central nervous systemin dogs: a retrospective study. Journal of Veterinary Internal Medicine. 1995;9(5):304–14.
THOMAS, William B. et al. Idiopathic Epilepsy in Dogs. Veterinary Clinics Of North America: Small Animal Practice, [S.L.], v. 30, n. 1, p. 183-206, jan. 2000. Elsevier BV. http://dx.doi.org/10.1016/s0195-5616(00)50009-6.
WEESE, J Scott; EVASON, Michelle. A Color Handbook: Infectious Diseases of the Dog and Cat. 1ª ed., FL: Taylor & Francis Group, 2020.
ZAJAC, Anne M. et al. Veterinary Clinical Parasitology. 9ª ed., Iowa: Wiley-Blackwell, 2021.

MSc Carina Freccia
Graduada em Medicina Veterinária pela Universidade do Estado de Santa Catarina (2010). Residência em Clínica Cirúrgica de Pequenos Animais pela Universidade do Estado de Santa Catarina (2013). Mestrado em Ciência Animal, área de atuação Cirurgia de Pequenos Animais, pela Universidade do Estado de Santa Catarina (2015). Pós-graduação em Ortopedia e Traumatologia de Pequenos Animais pela Universidade Federal do Rio Grande do Sul (2018). Pós-graduação em Neurologia e Neurocirurgia (Anclivepa-SP) (2023). Sócio-proprietária da clínica veterinária MCA Medical Vet, em Tubarão-SC. Presidente da Comissão de Pequenos Animais (CRMV-SC) Professora de graduação medicina veterinária da Unisul (campus Tubarão), Unidade Curricular Práticas Veterinárias e Clínica Cirúrgica de Cães e Gatos.

MSc DipECVN Dakir Polidoro
Graduação em Medicina Veterinária pela Universidade Federal de Santa Maria-RS; Mestrado em cirurgia e clínica veterinária com ênfase em neurologia pela Universidade Federal de Santa Maria-RS; Internato em cirurgia e clínica de pequenos animais pela Faculdade de Veterinária de Hannover – Alemanha; Residência em neurologia veterinária pela Universidade de Gent – Bélgica; Atualmente responsável pelo setor de neurologia e imagem da Clínica Veterinária AniCura Plantijn – Bélgica.
{PAYWALL_FIM}
