Por: M.J.D. Amâncio, M. Marchiori Filho, A. Leonelo Neto, G.M. de Andrade, R.A. Ré, M. Brunini, S. Sossai.
Perfil farmacocinético da cefalexina na forma de comprimido administrada em cães e sua correlação com a concentração inibitória mínima (CIM) para bactérias de importância clínica veterinária.
Pharmacokinetic profile of CEPHALEXINEA in tablet form administered in dogs and its correlation with Minimum Inhibitory Concentration (MIC) for bacteria of veterinary clinical importance.
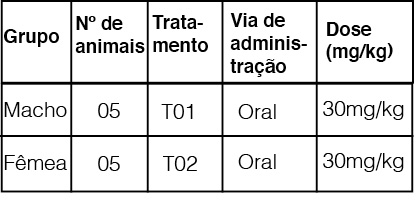
O presente estudo avaliou a correlação entre o perfil farmacocinético da CEFALEXINA e os valores de concentração inibitória mínima (CIM) obtidos das bactérias testadas. Os 10 cães utilizados foram divididos em Grupo Macho (T01) e Grupo Fêmea (T02), sendo tratados por via oral com a CEFALEXINA na dose de 30 mg/kg de peso corporal a cada 12h e então submetidos a coletas de sangue seriadas durante 24h. O perfil farmacocinético foi obtido por técnicas cromatográficas, enquanto a CIM por teste de disco-difusão em ágar. Através da correlação entre os resultados analíticos e microbiológicos, observou-se que a formulação avaliada foi eficaz contra as bactérias: E. coli, K. pneumoniae, P. multocida, P. mirabilis, S. typhimurium, S. aureus, S. epidermidis, S. intermedius e S. pyogenes.
{PAYWALL_INICIO}
Unitermos: Canis familiaris, medicamentos veterinários, antibacterianos, cefalosporinas, eficácia.
ABSTRACT:
The present study evaluated the correlation between CEPHALEXINA pharmacokinetics profile and the minimum inhibitory concentration (MIC) values obtained from the tested bacteria. The 10 dogs used were divided into Male Group (T01) and Female Group (T02). Both were treated orally with CEPHALEXINA at a dose of 30 mg/kg of body weight every 12h and then submitted to serial blood collections during 24h. The pharmacokinetic profile was obtained by chromatographic techniques, while the MIC by disk-diffusion agar test. Through the correlation between analytical and microbiological results, it was observed that the evaluated formulation was effective against the bacteria: E. coli, K. pneumoniae, P. multocida, P. mirabilis, S. typhimurium, S. aureus, S. epidermidis, S. intermedius and S. pyogenes.
Keywords: Canis familiaris, veterinary drugs, anti-bacterial agents, cephalosporins, efficacy.
INTRODUÇÃO
A cefalexina é uma cefalosporina de primeira geração frequentemente utilizada na medicina veterinária, principalmente, na clínica médica de pequenos animais para o tratamento de infecções de pele e de tecidos moles 1,2.
Por impedir a síntese da parede celular, estrutura fundamental para a manutenção da vida do micro-organismo, a cefalexina exerce ação bactericida, agindo, principalmente, contra bactérias Gram-positivas, como Streptococcus e Staphylococcus spp.; bactérias anaeróbias e algumas Gram-negativas, como Escherichia coli, Proteus e Klebsiella spp. 1,3.
Em conjunto com as penicilinas, as cefalosporinas se enquadram no grupo dos antimicrobianos betalactâmicos, os quais, por sua vez, são caracterizados como fármacos de ação tempo-dependente. Isto significa que, para determinar a sua eficácia, o fator de maior relevância é o período de tempo (T) no qual a sua concentração plasmática permanece acima da concentração inibitória mínima (CIM) para um dado micro-organismo (T > CIM)1. De forma geral, para estes antimicrobianos, o Ministério da Agricultura, Pecuária e Abastecimento (MAPA) tem considerado uma relação de eficácia aceitável quando o tempo acima da CIM alcança, no mínimo, 60% do intervalo entre doses preconizado para o princípio ativo em avaliação.
Portanto, o objetivo do presente estudo foi avaliar a eficácia da formulação CEFALEXINA por meio da correlação do seu perfil farmacocinético com as concentrações inibitórias mínimas (CIM) obtidas de bactérias isoladas de afecções clínicas em cães.
MATERIAIS E MÉTODOS
Animais Experimentais
Este estudo foi realizado com dez cães sem raça definida (SRD), machos e fêmeas, com idades entre 12 e 48 meses e peso corporal entre 10 e 25 kg, provenientes do Canil Experimental Nowavet, município de Coimbra, estado de Minas Gerais. Os animais foram alocados em dois grupos, Grupo Macho (T01) e Grupo Fêmea (T02), sendo mantidos em canis coletivos e alimentados com ração comercial e água ad libitum durante todo o período experimental. Os animais foram submetidos a um período de aclimatação de sete dias, sendo o presente estudo previamente aprovado pela Comissão de Ética no Uso de Animais (CEUA) da NOWAVET, sob número de protocolo 095/2016.
Tratamento
A formulação CEFALEXINA foi administrada a todos os animais experimentais, por via oral, em dose única de 30 mg/kg de peso corporal, conforme Figura 01.
Colheitas de Amostras para Análise
Amostras de sangue foram coletadas por punção da veia cefálica nos seguintes tempos: D-1 (antes do tratamento considerado como tempo zero (T0)); 30 min, 1 h, 1,5h, 2,5h. 3,5h, 4h, 5h, 6h, 7h, 8h, 9h, 12h e 24 h após a administração do produto para quantificação do ativo marcador no plasma.
Avaliação do Perfil Farmacocinético
O perfil farmacocinético da cefalexina foi obtido por meio da quantificação das concentrações plasmáticas (μg/mL) realizada por cromatografia líquida acoplada a espectrômetro de massas. A metodologia foi validada pela obtenção do erro analítico através das médias, desvio padrão, coeficientes de variação, curva de calibração, seletividade, LIQ, exatidão, precisão, efeito matriz, efeito residual, estabilidade e robustez, sendo todos os estudos realizados em amostras de matrizes brancas fortificadas.
Avaliação gráfica da Concentração Inibitória Mínima (CIM)
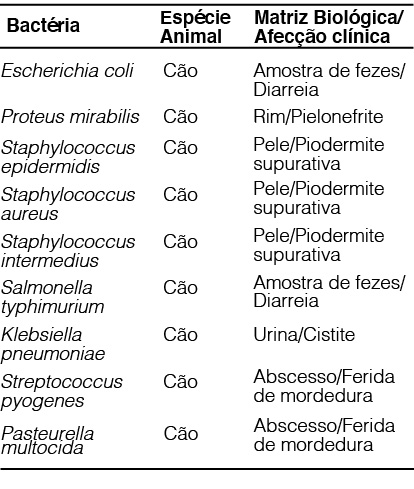
Para avaliação de correlação foram utilizados dados das concentrações inibitórias mínimas (CIMs) de diferentes agentes bacterianos selecionados, os quais foram isolados de casos clínicos de afecções bacterianas com grande recorrência na clínica médica de animais de companhia (Figura 02). Por sua vez, os dados da CIM foram obtidos através de ensaios in vitro realizados com o ativo cefalexina pela técnica de disco-difusão em ágar no Laboratório de Microbiologia da NOWAVET, seguindo as recomendações da CLSI (Clinical Laboratory Standards Institute).
Da correlação dos resultados analíticos e microbiológicos foram calculados os parâmetros farmacocinéticos para determinação da eficácia terapêutica da formulação teste. Por ser um fármaco de ação tempo-dependente, a eficácia da cefalexina é determinada pela porcentagem de tempo (T), dentro do intervalo entre doses indicado, em que a sua concentração plasmática permanece acima da concentração inibitória mínima (CIM) para um dado agente bacteriano (T>CIM), sendo considerada eficaz quando T>CIM>60%. Isto é, considerando a indicação do tratamento a cada 12 horas, é necessário que os níveis plasmáticos de cefalexina sejam superiores às CIMs por no mínimo 7,2 horas do tempo entre as doses (60% de 12 horas = 7,2 horas).
RESULTADOS E DISCUSSÃO
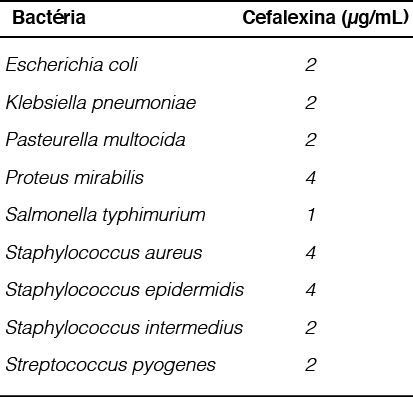
Os resultados dos ensaios de CIM (Concentração Inibitória Mínima) estão registrados na Figura 03. Pode-se observar que a faixa de Concentração Inibitória Mínima do ativo cefalexina frente aos micro-organismos testados foi entre 1 µg/mL e 4 µg/mL. Isto significa que os valores de CIM encontrados consistiram na menor concentração de cefalexina necessária para inibir o crescimento das respectivas bactérias isoladas de afecções clínicas de cães.
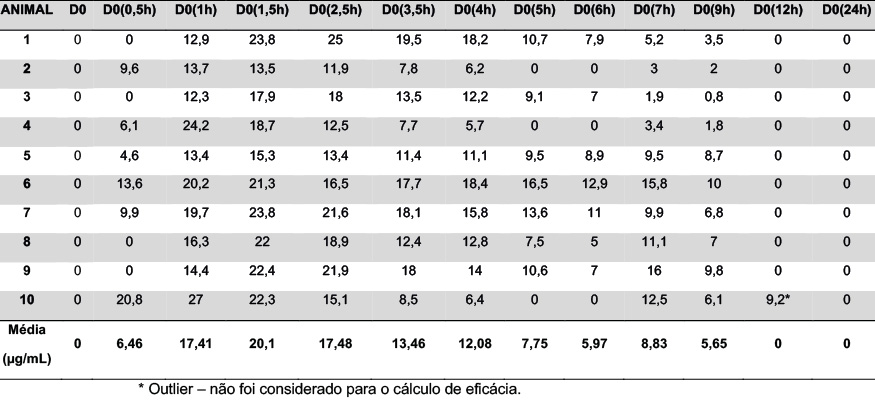
Através da quantificação do princípio ativo cefalexina no plasma dos animais tratados durante um período de tempo de 24h (Figura 04), pode-se observar que, de forma geral, a concentração plasmática do ativo elevou-se gradativamente após 30 minutos do tratamento (D0(0,5h), alcançando a concentração plasmática máxima média de 20,1 µg/mL no momento D0(1,5h). Posteriormente, os níveis plasmáticos reduziram-se gradativamente, não sendo mais quantificáveis nos momentos D0(9h) e D0(12h) por apresentarem-se abaixo do Limite de Quantificação (LIQ) de 0,1 µg/mL adotado no presente estudo.
A correlação destes resultados analíticos e microbiológicos viabilizou a obtenção das curvas farmacocinéticas da formulação CEFALEXINA, as quais encontram-se representadas nas Figuras 05, 06 e 07. Como pode ser observado nas figuras retromencionadas, a curva de concentração plasmática manteve-se superior a todas as CIM testadas durante a maior parte do intervalo entre doses de 12 horas preconizado para o produto teste. Para o grupo 1 de bactérias (Salmonella typhimurium), a concentração plasmática do ativo permaneceu por 11,40 horas acima da CIM de 1 µg/mL, sendo este tempo equivalente a 95,0% do período de 12h indicado. Para o grupo 2 (Escherichia coli, Klebsiella pneumoniae, Pasteurella multocida, Staphylococcus intermedius, e Streptococcus pyogenes), a concentração plasmática permaneceu por 10,80 horas acima da CIM de 2 µg/mL, sendo equivalente a 90,0% do período de 12h indicado. Por fim, para o grupo 3 (Proteus mirabilis, Staphylococcus aureus e Staphylococcus epidermidis), a concentração plasmática do ativo testado permaneceu por 9,60 horas acima da CIM de 4 µg/mL, sendo equivalente a 80,0% do período de 12h preconizado.
Considerando o parâmetro farmacocinético T>CIM>60% e o intervalo entre tratamentos de 12 horas, o ponto de corte estabelecido para definição da eficácia foi de 7,2 horas (60% do tempo de tratamento). Os cálculos para estes parâmetros estão registrados na Figura 08. Pode-se observar que a formulação testada foi considerada eficaz contra os três grupos de bactérias testados, uma vez que permaneceu acima da porcentagem mínima de tempo de 60%, preconizada pelo Ministério da Agricultura, Pecuária e Abastecimento, durante o intervalo entre doses indicado de 12h.
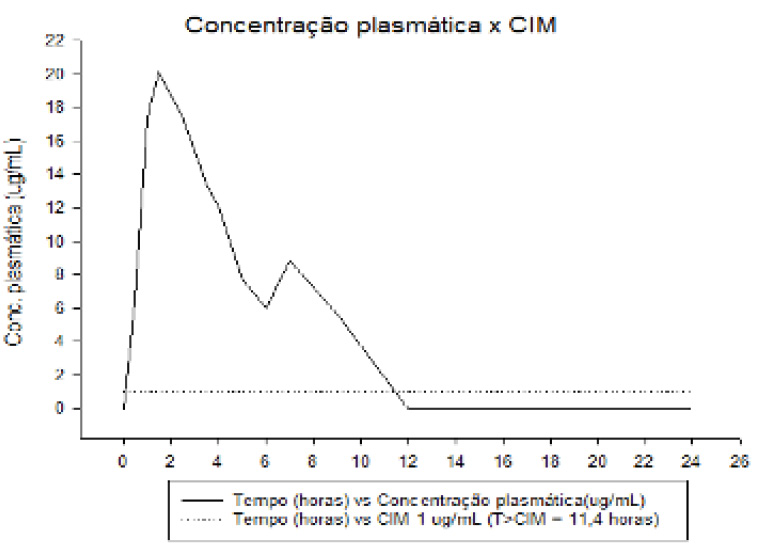
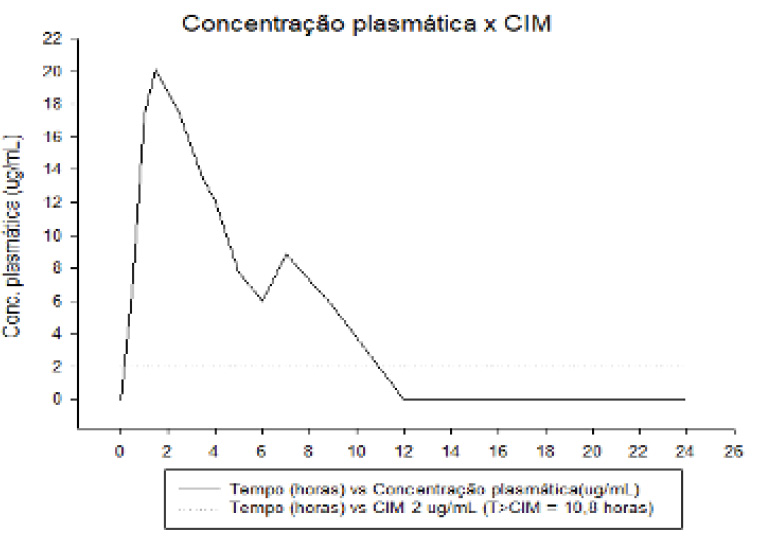
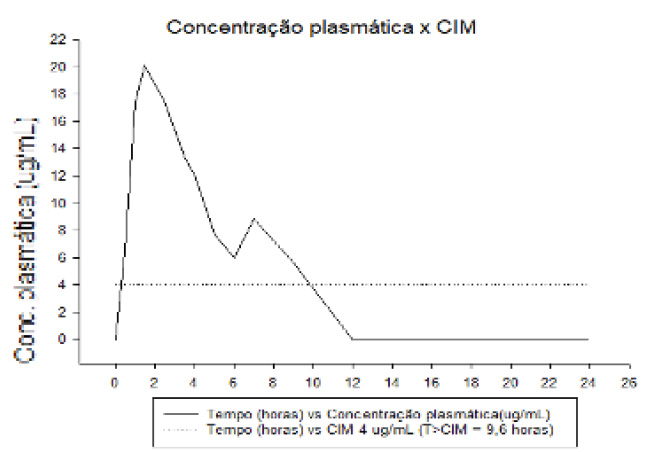
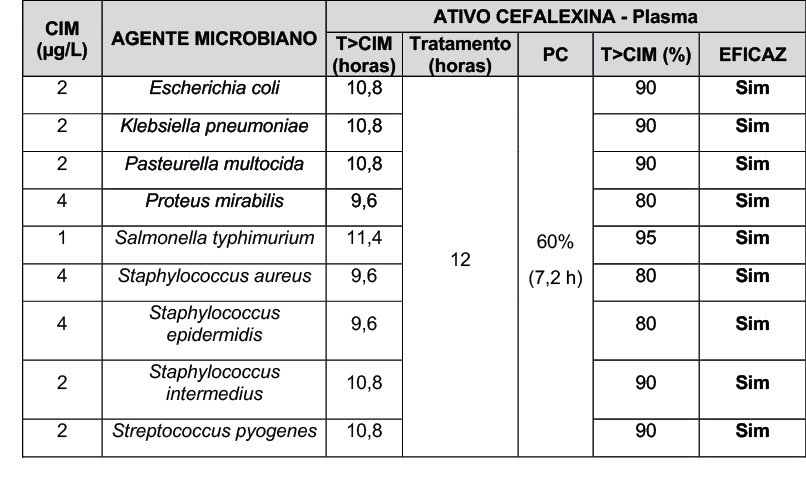
T: tempo CIM: concentração inibitória mínima; T>CIM: tempo maior que concentração inibitória mínima;
Os resultados de eficácia da formulação CEFALEXINA assemelham-se aos já obtidos por outros autores, que também relatam a susceptibilidade de bactérias do gênero Staphylococcus spp., isoladas de casos de piodermites caninas, ao antimicrobiano cefalexina, apresentando percentuais de sensibilidade de 90 a 100% 4-8. A literatura também menciona atividade efetiva contra Escherichia coli, Pasteurella multocida, Proteus mirabilis, Klebsiella pneumoniae e Salmonellae 9,10, corroborando com os achados do presente estudo.
Dessa forma, sendo estes agentes frequentemente associados às afecções bacterianas de maior ocorrência em cães, a cefalexina pode ser indicada como o princípio ativo de primeira escolha no tratamento destas patologias, principalmente, as de origem cutânea, como piodermites superficiais e profundas 11.
CONCLUSÃO
O produto CEFALEXINA, quando realizada a correlação entre o seu perfil farmacocinético e a CIM de cães submetidos ao tratamento com a dosagem de 30 mg/kg do produto a cada 12 horas, foi eficaz contra as cepas: Escherichia coli, Klebsiella pneumoniae, Pasteurella multocida, Proteus mirabilis, Salmonella typhimurium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus intermedius e Streptococcus pyogenes. Podendo ser considerada uma alternativa para o clínico veterinário no tratamento de patologias bacterianas que acometem os cães.
REFERÊNCIAS
1 – SPINOSA, H. S. Antibióticos que interferem na síntese da parede celular: betalactâmicos. In: SPINOSA, H. S.; GÓRNIAK, S. L.; BERNARDI, M. M. Farmacologia aplicada à medicina veterinária. 5. ed. Rio de Janeiro: Guanabara Koogan, 2011. cap. 36, p. 732-745.
2 – PRADOS, A. P.; SCHAIQUEVICH, P.; KREIL, V.; MONFRINOTTI, A.; QUAINE, P.; TARRAGONA, L.; HALLU, R.; REBUELTO, M. A population pharmacokinetic approach to describe cephalexin disposition in adult and aged dogs. Veterinary Medicine International, 2014:789353. doi: 10.1155/2014/789353.
3 – GRIFFITH, R. S.; BLACK, H. R. Cephalexin. Medical Clinics of North America, v. 54, p. 1229–1244, 1970.
4 – PIANTA, C.; OLIVEIRA, S. J.; FALLAVENA, L. C. B.; ESMERALDINO, A. T.; SILVA JÚNIOR, V. B. Pioderma estafilocócico canino: identificação das espécies e sensibilidade aos antimicrobianos. Revista de Ciência Agroveterinárias, Lages, v. 5, n. 1, p. 60-63, 2006.
5 – SILVA, A. P.; SCHMIDT, C.; VARGAS, A. C.; MARBONI, G.; RAMPELOTTO, C.; SCHWAB, M. L.; ESCOBAR, T. P.; AMARAL, A. S. Suscetibilidade antimicrobiana de Staphylococcus spp. isolados de cães com pioderma superficial. Pesquisa Veterinária Brasileira, Santa Maria, v. 34, n. 4, p. 355-361, 2014.
6 – CAVALCANTI, S. N.; COUTINHO, S. D. Identificação e perfil de sensibilidade antimicrobiana de Staphylococcus spp. isolados de pele de cães sadios e com piodermite. Revista Clínica Veterinária, São Paulo, n. 58, p. 60-66, 2005.
7 – NOBLE, W. C; KENT, L. E. Antibiotic resistance in Staphylococcus intermedius isolated from cases of pyoderma in the dog. Veterinary Dermatology, v. 3, n. 2, p. 71-74, 1992.
8 – RAVENS, P. A.; VOGELNEST, L. J.; EWEN, E.; OSWARD, K. L.; NORRIS, J. M. Canine superficial bacterial pyoderma: evaluation of skin surface sampling methods and antimicrobial susceptibility of causal Staphylococcus isolates. Australian Veterinary Journal, v. 92, n. 5, p. 149-155, 2014.
9 – SILLEY, P.; BREWSTER, G. Kill kinetics of the cephalosporin antibiotics cephalexin and cefuroxime against bacteria of veterinary importance. The Veterinary Record, v. 123, n. 13, p. 343-345, 1988.
10 – BAILEY, A.; WALKER, A.; HADLEY, A.; JAMES, D. G. Cephalexin – a new oral antibiotic. Postgraduate Medical Journal, v. 46, n. 533, p. 157-158, 1970.
11 – HILLIER, A.; LLOYD, D. H.; WEESE, J. S.; BLONDEAU, J. M.; BOOTHE, D.; BREITSCHWERDT, E.; GUARDABASSI, L.; PAPICH, M. G.; RANKIN, S.; TURNIDGE, J. D.; SYKES, J. E. Guidelines for the diagnosis and antimicrobial therapy of canine superficial bacterial folliculitis (Antimicrobial Guidelines Working Group of the International Society for Companion Animal Infectious Diseases). Veterinary Dermatology, v. 25, n. 3, p. 163-e43, 2014.
LISTA DE ABREVIATURAS E SIGLAS
CEUA Comissão de Ética no Uso de Animais
CIM Concentração Inibitória Mínima
CLSI Clinical Laboratory Standards Institute
D0 Dia Zero
h Hora
Kg Quilogramas
LIQ Limite de Quantificação
MAPA Ministério da Agricultura Pecuária e Abastecimento
MIC Minimum Inhibitory Concentration
min Minutos
mL Mililitro
SRD Sem Raça Definida
T Tempo
T0 Tempo Zero
μg Microgramas

Maria Júlia Dias Amâncio
Títulos: Médica Veterinária (UNESP/Jaboticabal). CRMV-SP 46.821

Moacir Marchiori Filho
Títulos: Médico Veterinário (UFU), Mestre e Doutor em Medicina Veterinária Preventiva (UNESP/Jaboticabal e USP/São Paulo), MBA em Gestão Estratégica e Econômica do Projetos (FGV) e MBA em Administração de Empresas (FGV). CRMV-SP 10.612

Gisele Maria de Andrade
Títulos: Médica Veterinária (UEL), Mestre em Sanidade Animal (UEL), Doutorado em Medicina Veterinária – Protozoários (UNESP/Jaboticabal). CRMV-SP 19.416

Raquel Amador Ré Okada
Títulos: Bacharel em Química e Farmacêutica Generalista

Armando Leonelo Neto
Títulos: Farmacêutico Industrial (UFOP), MBA em Gerenciamento de Projetos (FGV).

Marcelo Brunini Rodrigues
Títulos: Médico (UNICAMP), MBA e Mestrado em Biotecnologia.

Sidimar Sossai
Títulos: Médico Veterinário (UFV), Mestre em Medicina Veterinária com ênfase em biologia molecular de parasitos (UFV), Doutor em Medicina Veterinária com ênfase em biotecnologia, processos fermentativos, desenvolvimento de vacinas e pesquisa clínica veterinária (UFV). CRMV-MG 7029
{PAYWALL_FIM}
